
有一个处于平衡状态的反应:X(g)+3Y(g) ![]() 2Z(g)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( )
2Z(g)(正反应为放热反应)。为了使平衡向生成Z的方向移动,应选择下列的适宜条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥除去Z
A.①④⑥ B.②③⑤ C.①③⑥ D.②③⑥
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:阅读理解
 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 4 |
| 3 |
| 4 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.一个N≡N形成的同时,有3个H-H键形成
B.一个N≡N断裂的同时,有3个H-H键断裂
C.一个N≡N断裂的同时,有6个N-H键断裂
D.一个N≡N断裂的同时,有6个N-H键形成
查看答案和解析>>
科目:高中化学 来源:0108 期末题 题型:填空题
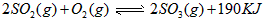
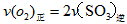
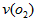 =_________mol·L-1·min-1,若继续通入0.20mol SO2和0.10mol O2,则平衡_________移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,_______mol
=_________mol·L-1·min-1,若继续通入0.20mol SO2和0.10mol O2,则平衡_________移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,_______mol查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com