
| A. | 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间 | |
| B. | NaCl溶液是电解质,因为NaCl溶液能导电 | |
| C. | Na和H2O的反应不是离子反应,因为反应中没有离子参加 | |
| D. | H2SO4是酸,因为H2SO4中含有氢元素 |
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ②⑥ | C. | ①⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.
以天然气为原料合成甲醇常见的方法有水煤气法和目前正在开发的直接氧化法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水电离出的c(H+)=1×10-13mol/L的溶液中下列离子一定能大量共存:Na+、CO32-、Cl-、K+ | |
| B. | 氢氧根离子浓度相同的氢氧化钠溶液和氨水导电能力相同 | |
| C. | K2SO3溶液中c(K+)与c(SO32-)之比为2:1 | |
| D. | 硫酸是强电解质,故纯硫酸能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | σ键是由两个p电子“肩并肩”重叠形成的 | |
| B. | σ键和π键都是共价键,σ键比π键更稳定 | |
| C. | 乙烯分子中的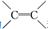 和乙炔分子中的-C≡C-都是π键 和乙炔分子中的-C≡C-都是π键 | |
| D. | H2分子中含有σ键,HCl分子中含π键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为△H=-285.5k•Jmol-1,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$2H2(g)+O2(g)△H=+285.5k•Jmol-1 | |
| B. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6kJ•mol-1 | |
| C. | 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6k•Jmol-1 | |
| D. | 相同条件下,在两个相同的恒容密闭容器中,1molN2和3molH2反应放出的热量与2molN2和3molH2反应放出的热量一样多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦⑨ | B. | ②④⑧⑩ | C. | ①③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肼(N2H4)的性质类似于氨气,易溶于水,是塑料、橡胶发泡剂的原料.将肼蒸气通入Cu0胶体中,可发生如图所示的转化.
肼(N2H4)的性质类似于氨气,易溶于水,是塑料、橡胶发泡剂的原料.将肼蒸气通入Cu0胶体中,可发生如图所示的转化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
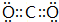 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com