
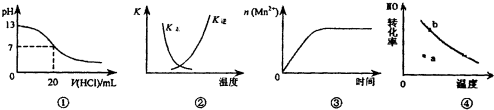
| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0,1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g):△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 图④曲线表示2NO+O2?2NO2中NO的最大转化率与温度的关系,a点表示未达到平衡状态,且v(正)<v(逆) |
分析 A、当溶液pH=7时,氢氧化钠就与氯化氢恰好反应,滴定曲线应该有一个滴定突变;
B、该反应为放热反应,温度升高,平衡向着逆向移动,K(逆)增大、K(正)减小;
C、KMnO4和 H2C2O4反应生成的Mn2+是此反应的催化剂;
D、NO的最大转化率即平衡转化率,而a点时NO的转化率比平衡转化率偏低.
解答 解:A、用盐酸滴定氢氧化钠溶液,当恰好中和时溶液的pH=7,酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,题中图象变化与实际不相符,故A错误;
B、因反应为放热反应,则升高温度,平衡逆向移动,平衡后升温K(逆)会增大,而K(正)会减小,图象中变化与实际上的变化相符,故B正确;
C、KMnO4和 H2C2O4反应生成的Mn2+是此反应的催化剂,故反应开始比较慢,但一旦开始,则反应越来越快,故生成的n(Mn2+)与时间不成直线关系,故C错误;
D、NO的最大转化率即平衡转化率,而a点时NO的转化率比平衡转化率偏低,故此时平衡向右移才能达平衡,故v(正)>v(逆),故D错误.
故选B.
点评 本题考查酸碱中和滴定、平衡常数影响因素、催化剂对反应速率的影响等,侧重考查学生读图获取信息的能力、知识迁移运用能力,主要考查一些细节问题,属于易错题目.


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:解答题
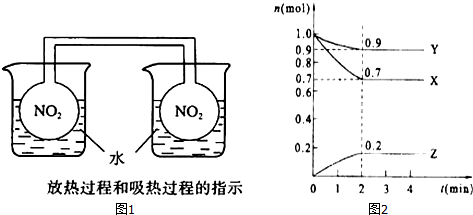
 2Z;
2Z;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式: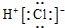 | B. | CO2分子的结构式:O=C=O | ||
| C. | Na的原子结构示意图: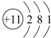 | D. | 钙离子的电子式:Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
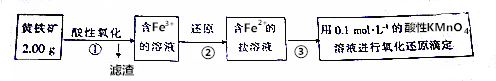
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ( D)=0.4 mol/(L•s) | B. | v( C)=0.8mol/(L•s) | C. | υ( B)=0.6 mol/(L•s) | D. | υ( A)=0.5 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
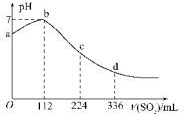 标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )
标准状况下,某同学向100mLH2S饱和溶液中通入SO2,所得溶液pH变化如图所示,下列分析中,正确的是( )| A. | 亚硫酸是比氢硫酸更弱的酸 | |
| B. | ab段反应是:SO2+2H2S═3S↓+2H2O | |
| C. | 原H2S溶液的物质的量浓度为0.05 mol/L | |
| D. | b点对应的溶液导电性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+HCl $→_{△}^{催化剂}$ CH3CH2Cl | |
| B. | CH4+Cl2 $\stackrel{光}{→}$CH3Cl+HCl | |
| C. | nCH2=CH2$→_{加热、加压}^{催化剂}$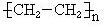 | |
| D. | CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO | B. | CO | C. | SiO2 | D. | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
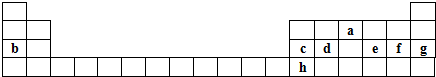
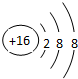 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com