
分析 测定产品中氯化物试样中氯的含量,滴加硝酸银,根据硝酸银的物质的量可确定质量分数;
解答 解:n(AgNO3)=c(AgNO3)V=0.1036mol/L×0.02085L=0.00216mol
Ag++Cl-=AgCl↓
1 35.5
0.00216 m
$\frac{1}{0.00216}=\frac{35.5}{m}$,m=0.07668g
m总(氯化物)=0.07668g×$\frac{250ml}{25ml}$=0.7668g
w(氯化物)=$\frac{0.7668g}{1.3060g}$×100%=58.71%
答:氯化物试样中氯的质量分数为58.71%.
点评 本题考查测定产品中氯化物试样中氯的含量,主要是根据硝酸银的物质的量,确定含氯化合物的两,题目简单.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
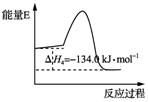 我国利用合成气直接制烯烃获重大突破,其原理是( )
我国利用合成气直接制烯烃获重大突破,其原理是( )| A. | 反应③使用催化剂,△H3减小 | |
| B. | 反应④中正反应的活化能大于逆反应的活化能 | |
| C. | △H1-△H2<0 | |
| D. | 3CO(g)+6H2(g)?CH3CH═CH2(g)+3H2O(g)△H=-121.1 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚晶体隔绝空气密封保存 | |
| B. | 氢氧化钠溶液保存在带橡皮塞的玻璃试剂瓶中 | |
| C. | 少量的钠保存在乙醇中 | |
| D. | 新制的氯水通常保存在棕色玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 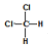 和 和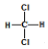 、 、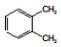 和 和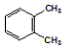 属于同分异构体 属于同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaX |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com