
 甲醛是深受关注的有机化合物.甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠.
甲醛是深受关注的有机化合物.甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠.分析 已知产生的氢氧化钠的物质的量与甲醛的物质的量相等;
(1)将8.00mL甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,得到溶液中含有NaOH,由硫酸的物质的量可得NaOH,以此确定甲醛的物质的量,进而计算浓度;
(2)若滴定管规格为50mL,如硫酸全部反应,体积为50mL,则可知消耗硫酸的物质的量,可知需要甲醛的物质的量,结合(1)浓度,可确定体积;
(3)①如果H2O2用量不足,则HCHO未被完全氧化,生成HCOOH偏低,消耗的NaOH偏低,会导致甲醛含量的测定结果偏低,如果H2O2过量,导致部分HCOOH进一步被氧化生成二氧化碳或碳酸,消耗氢氧化钠偏少;
②酚酞试液遇碱性溶液变红色,根据滴定终点时溶液的酸碱性判断颜色;
③滴定管的0刻度在上方,越往下读数越大.
解答 解:产生的氢氧化钠的物质的量与甲醛的物质的量相等,
(1)n(H2SO4)=1.100mol/L×0.02L=0.022mol,
将8.00mL甲醛水溶液加入到经调至中性的亚硫酸钠溶液中,充分反应后,得到溶液中含有NaOH,加入硫酸发生H2SO4+2NaOH=Na2SO4+2H2O,
则n(HCHO)=n(NaOH)=2n(H2SO4)=0.044mol,
c(HCHO)=$\frac{0.044mol}{0.008L}$=5.5mol/L,
故答案为:5.5;
(2)若滴定管规格为50mL,如硫酸全部反应,体积为50mL,则可知消耗硫酸的物质的量为0.05L×1.1mol/L=0.055mol,
则n(HCHO)=n(NaOH)=2n(H2SO4)=0.11mol,
甲醛水溶液取样不能超过的体积为 $\frac{0.11mol}{5.5mol/L}$=0.02L=20mL,
故答案为:20;
(3)①发生HCHO+H2O2→HCOOH+H2O,NaOH+HCOOH→HCOONa+H2O,关系式为HCHO~NaOH,如果H2O2用量不足,则HCHO未被完全氧化,生成HCOOH偏低,消耗的NaOH偏低,会导致甲醛含量的测定结果偏低,
如果H2O2过量,导致部分HCOOH进一步被氧化生成二氧化碳或碳酸,二氧化碳逸出导致消耗氢氧化钠偏少,
故答案为:偏低;HCHO未被完全氧化;偏低;部分HCOOH被氧化;
②甲酸与NaOH溶液完全中和时生成的甲酸钠溶液显碱性,则滴定终点时溶液由无色变为红色,故答案为:溶液由无色变为红色;
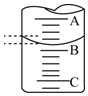
③50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,故答案为:25.40.
点评 本题为综合性考查,以甲醛为载体综合考查物质的性质探究以及含量测定,侧重于学生的分析、实验和计算能力的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度中等.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温时0.1mol/L乙酸溶液的pH=3 | |
| B. | 常温时0.1mol/L的乙酸钠溶液能使红色石蕊试纸变蓝 | |
| C. | 0.1mol/L的乙酸溶液与同体积0.1mol/L的氢氧化钠溶液恰好反应 | |
| D. | 0.1mol/L乙酸溶液的导电性比0.1mol/L盐酸弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④⑤⑥ | C. | ⑤ | D. | ①⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+)=10-7mol•L-1 | |
| B. | 将AlCl3溶液、Na2SO3溶液蒸干并灼烧可以得到Al2O3、Na2SO3 | |
| C. | 常温下0.1mol•L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)=10-10mol•L-1 | |
| D. | 常温下pH=2的盐酸和pH=12的氨水等体积混合后c(Cl-)+c(H+)<c(NH4+)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸保存在棕色橡胶塞的试剂瓶中 | |
| B. | 用溴的四氯化碳溶液除去甲烷中的乙烯杂质 | |
| C. | 酸碱中和滴定实验中,锥形瓶用蒸馏水洗涤后,不需要干燥 | |
| D. | 配制NH4Fe(SO4)2标准溶液时,加入一定量HCl以防水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,Li+在电解质中由负极向正极迁移 | |
| B. | 放电时,负极的电极反应式为LixC6-xe-=xLi++C6 | |
| C. | 充电时,若转移1mole-,石墨C6电极将增重7xg | |
| D. | 放电时,正极上锂元素的化合价没有改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现 象 | 解释或结论 |
| A | 在KSCN与FeCl3的混合液中再加入KCl固体 | 溶液颜色变浅 | 增大Cl-浓度,平衡逆向移动 |
| B | 将氯化铝溶液蒸干 | 析出白色固体 | 白色固体是氯化铝 |
| C | 向某溶液中滴加NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| D | 石蕊试液中通入氯气 | 溶液先变红后红色褪去 | 氯气与水反应产生了酸和漂白性物质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
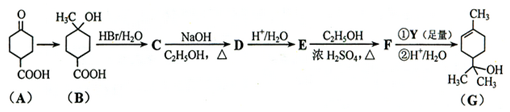
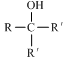
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com