
 碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.
碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的某本原料.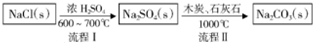
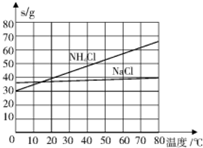
| 物质 | NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| s/g | 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
分析 Ⅰ.路布兰法是利用食盐晶体和浓硫酸在高温下反应生成硫酸钠和氯化氢,再利用C与石灰石和硫酸钠高温加热生成碳酸钠;
(1)流程Ⅰ生成硫酸钠,另一种产物可利用质量守恒或原子守恒判断;
(2)硫化钠与石灰石发生复分解反应的化学方程式为Na2S+CaCO3$\frac{\underline{\;高温\;}}{\;}$Na2CO3+CaS,将两方程式相加即可得到总反应式;
Ⅱ.索尔维用氨碱法生产碳酸钠,反应原理为利用氨化饱和的NaCl与CO2反应得到NaHCO3,将碳酸氢钠分解即可得到纯碱碳酸钠;
(3)索尔维用氨碱法生产碳酸钠,原料CO2来源于石灰石(CaCO3)的分解,另需食盐、氨气及水;因碳酸氢钠分解生成CO2和纯碱,氯化铵晶体分解生成氨气;
(4)相同温度下,碳酸氢钠的溶解度明显小于碳酸钠;NH3极易溶解于水且溶液显碱性,先通入NH3得到的碱性溶液可增加CO2气体的溶解度;
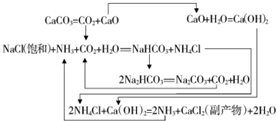
Ⅲ.侯德榜研究出联合制碱法为在饱和的氯化钠溶液中直接通入氨气和CO2,得到氯化铵和碳酸氢钠晶体,并利用碳酸氢钠的分解制得纯碱;
(5)侯氏制碱法结晶出碳碳酸氢钠后的溶液中主要存在氯化铵,加入氯化钠并通NH3,可促进NH4Cl(s)?NH4+(aq)+Cl-(aq)溶解平衡逆向移动,析出晶体氯化铵;可选择在低温下进行,以防止析出其他晶体.
解答 解:Ⅰ.路布兰法是利用食盐晶体和浓硫酸在高温下反应生成硫酸钠和氯化氢,再利用C与石灰石和硫酸钠高温加热生成碳酸钠;
(1)流程Ⅰ利用高沸点酸制挥发性酸原理,氯化钠与浓硫酸混合加热,生成硫酸钠和氯化氢,故答案为:HCl;
(2)a.Na2SO4+4C$\stackrel{1000℃}{=}$Na2S+4CO↑;b.Na2S与石灰石发生复分解反应的化学方程式为Na2S+CaCO3$\frac{\underline{\;高温\;}}{\;}$Na2CO3+CaS,将两方程式相加即可得到总反应式Na2SO4+4C+CaCO3$\frac{\underline{\;1000℃\;}}{\;}$Na2CO3+4CO↑+CaS,
故答案为:Na2SO4+4C+CaCO3$\frac{\underline{\;1000℃\;}}{\;}$Na2CO3+4CO↑+CaS;
Ⅱ.索尔维用氨碱法生产碳酸钠,反应原理为利用氨化饱和的NaCl与CO2反应得到NaHCO3,将碳酸氢钠分解即可得到纯碱碳酸钠;
(3)索尔维用食盐、水、氨气和CO2反应制备碳酸氢钠,其中可利用石灰石(CaCO3)分解得到CO2;碳酸氢钠分解纯碱,同时得到CO2,另外副产品氯化铵晶体分解能生成氨气,两气体均可循环利用,
故答案为:石灰石、NH3和食盐;CO2和NH3;
(4)因相同温度下,碳酸氢钠的溶解度明显小于碳酸钠,则饱和NaCl溶液通NH3和CO2只能生成NaHCO3;CO2在水中溶解度小,但极易溶解在碱性溶液中,而NH3极易溶解于水且溶液显碱性,则先通入NH3得到的碱性溶液可增加CO2气体的溶解度;
故答案为:反应体系中NaHCO3的溶解度最小;NH3;因为氨气的溶解度远大于CO2;
Ⅲ.侯德榜研究出联合制碱法为在饱和的氯化钠溶液中直接通入氨气和CO2,得到氯化铵和碳酸氢钠晶体,并利用碳酸氢钠的分解制得纯碱;
(5)在含有氯化铵的滤液中,加入氯化钠并通NH3,可提高溶液中Cl-和NH4+的浓度,促进NH4Cl(s)?NH4+(aq)+Cl-(aq)溶解平衡逆向移动,析出晶体氯化铵;因NH4Cl低温下溶解度比较小,低温更易NH4Cl晶体析出,并以防止析出其他晶体;故答案为:NH4Cl晶体;0~10℃.
点评 本题探究三种不同情况制备纯碱碳酸钠的实验原理,涉及反应原理、溶解度及混合物的分离操作,属基础性考查,难度适中,难点为反应原理的分析.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:解答题
| 元 素 | Mn | Fe | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维、氧化铝陶瓷、硅藻土都是无机非金属材料 | |
| B. | 节能减排防治PM2.5,PM2.5是指大气中直径小于或等于2.5纳米的可吸入颗粒物 | |
| C. | 汽车尾气中的氮氧化物和碳氢化合物在大气环境中受强烈的太阳紫外线照射后产生一种新的二次污染物-光化学烟雾也会引起雾霾,汽车尾气中含有氮氧化物的原因是汽油燃烧不充分 | |
| D. | 超级病菌NDM-l几乎对所有抗生素都具有抗药性,死亡率很高.为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等氧化性强的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ K+ Na+ CO32- NO3- | B. | K+ Na+ Fe2+ SO42- NO3- | ||
| C. | NH4+ K+ Na+ HCO3-Cl- | D. | NH4+ K+ Na+ NO3- I- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.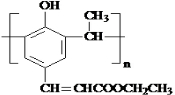 .
. +
+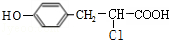 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +HCl.
+HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 广告语“农家肥蔬菜,无公害,绝对不含任何化学物质” | |
| B. | 医用酒精是利用了乙醇的氧化性来杀菌消毒的 | |
| C. | 面食加工时加入少量苏打粉时是防止酸败,加入少量小苏打粉时是作膨松剂 | |
| D. | 空气质量日报中计入污染指数的项目为可吸入颗粒物、SO2、NOx、CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 相 关 实 验 | 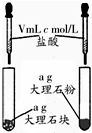 | 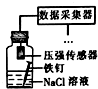 | 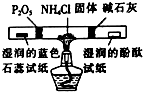 | 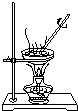 |
| 目的 | 探究接触面积对反应速率的影响 | 判断铁钉的 腐蚀类型 | 检验NH4Cl的 分解产物 | 直接蒸干FeSO4饱和溶液制备无水FeSO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 如图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1:1.甲是发酵粉的主要成分,乙是一种常用的化肥.B、D常温常压下是气体.请回答下列问题:
如图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1:1.甲是发酵粉的主要成分,乙是一种常用的化肥.B、D常温常压下是气体.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com