
| 元素 | 相关信息 |
| X | 原子核内无中子 |
| Y | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Z | 地壳中含量最高的元素 |
| W | 原子质量数为23,中子数为12 |
| R | 其离子是第三周期金属元素的离子中半径最小的 |
 ,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.
,X、Y、Z形成的化合物可用作化肥,该物质所含化学键的类型是离子、共价(填共价或离子);X与Z形成的18e-微粒的结构式为H-O-O-H.分析 X、Y、Z、W、R是短周期中的常见元素,X原子核内无中子,X为H;Y是组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2,则Y为N;Z是地壳中含量最高的元素,则Z是O;W质量数为23,中子数为12,W的质子数是11,为Na;R其离子是第三周期金属元素的离子中半径最小的,R为Al,一般电子层数越多半径越大,相同电子层数,原子序数越小半径越大;元素非金属性越强氢化物越稳定;工业上用电解熔融氧化铝制备铝,据此分析回答.
解答 解:X、Y、Z、W、R是短周期中的常见元素,X原子核内无中子,X为H;Y是组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2,则Y为N;Z是地壳中含量最高的元素,则Z是O;W质量数为23,中子数为12,W的质子数是11,为Na;R其离子是第三周期金属元素的离子中半径最小的,R为Al,
(1)一般电子层数越多半径越大,相同电子层数,原子序数越小半径越大,所以N、O、Na、Al四种元素的原子半径从大到小的顺序是Na>Al>N>O,
故答案为:Na>Al>N>O;
(2)Y2为氮气,电子式为 ,X、Y、Z形成的化合物可用作化肥,该物质为硝酸铵,所含化学键的类型是离子键和共价键,
,X、Y、Z形成的化合物可用作化肥,该物质为硝酸铵,所含化学键的类型是离子键和共价键,
故答案为: ;离子、共价;
;离子、共价;
(3)砷(As)是人体必需的微量元素,与N元素同一主族,As原子比N原子多两个电子层,则砷的原子序数为7++8+18=33,砷的最高化合价为+5价,所以其最高价氧化物的化学式为As2O5,同一主族元素中,随着原子序数的增大其气态氢化物的稳定性逐渐减小,所以该族2~4周期元素的气态氢化物的稳定性从大到小的顺序是NH3>PH3>AsH3 ,
故答案为:33;As2O5;NH3>PH3>AsH3 ;
(4)钠有三个电子层,最外层有1个电子,为与周期表中第三周期第ⅠA族,熔沸点高低、化合价与金属性无必然联系,不能用于判断金属性强弱,金属与水反应越剧烈金属性越强,最高价氧化物对应水化物的碱性越强金属性越强,故ab错误,cd正确,
故答案为:第三周期第ⅠA族;cd;
(5)工业上用电解熔融氧化铝制备铝,方程式为2Al2O3$\frac{\underline{\;电解\;}}{熔融}$4Al+3O2↑,
故答案为:2Al2O3$\frac{\underline{\;电解\;}}{熔融}$4Al+3O2↑.
点评 本题考查较综合,题目难度中等,正确推断元素的种类为解答该题的关键,涉及了原子结构、电子式、化学键、金属性、金属冶炼等知识点,要求学生熟练掌握元素化合物的基础知识.


科目:高中化学 来源: 题型:选择题
| A. | 质子数为118,电子数为179,中子数为179 | |
| B. | 原子序数为179,质量数为297 | |
| C. | 与612C的相对原子质量之比为118:6 | |
| D. | 118297X经过一次α衰变得到的116号元素原子可表示116293X |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
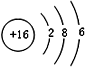 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
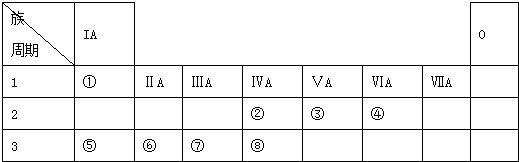
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/10-10m | 0.77 | 0.99 | 1.86 | 0.75 | 1.17 | 1.02 | 1.43 | 0.71 | 1.52 | 0.89 |
| 最高正化合价 | +4 | +7 | +1 | +5 | +4 | +6 | +3 | +1 | +2 | |
| 最低负化合价 | -4 | -1 | -3 | -4 | -2 | -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe3+、SO42-、Cl- | B. | CO32-、PO43-、K+、Na+ | ||
| C. | Na+、SO42-、NO3-、Cl- | D. | HCO3-、Na+、HSO3-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com