
| A. | ②④ | B. | ①③ | C. | ①⑤ | D. | ③⑤ |
分析 ①$\frac{{K}_{w}}{c({H}^{+})}$=0.01mol/L的溶液中,c(OH-)>c(H+),溶液呈碱性;
②无色溶液中不含有色离子;
③加入Al能放出H2的溶液为弱氧化性酸或强碱溶液;
④能使甲基橙试液显红色的溶液呈强酸性;
⑤由水电离出的c(OH-)=1×10-13 mol/L的溶液呈酸性或碱性.
解答 解:①$\frac{{K}_{w}}{c({H}^{+})}$=0.01mol/L的溶液中,c(OH-)>c(H+),溶液呈碱性,这几种离子之间不反应且和氢氧根离子不反应,所以能大量共存,故正确;
②无色溶液中不含有色离子,MnO4-为红色,不符合无色条件,故错误;
③加入Al能放出H2的溶液为弱氧化性酸或强碱溶液,酸性条件下HCO3-反应生成二氧化碳和水而不能大量共存,碱性条件下HCO3-、NH4+和氢氧根离子反应而不能大量共存,故错误;
④能使甲基橙试液显红色的溶液呈强酸性,I-、NO3-发生氧化还原反应而不能大量共存,故错误;
⑤由水电离出的c(OH-)=1×10-13 mol/L的溶液呈酸性或碱性,这几种离子之间不反应且和氢离子或氢氧根离子都不反应,所以能大量共存,故正确;
故选C.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存体积是解本题关键,涉及水的电离、溶液酸碱性判断、离子性质等知识点,注意④中发生的反应,为易错点.


科目:高中化学 来源: 题型:解答题
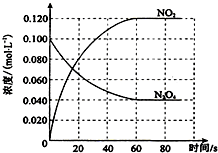 在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.
在容积为100L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钙(CaO2)的电子式: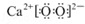 | |
| B. | 某微粒的结构示意简图为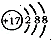 ,则该元素在周期表中位于第三周期、VIA族 ,则该元素在周期表中位于第三周期、VIA族 | |
| C. | H2CO3的电离方程式:H2CO3?2H++CO32- | |
| D. | 葡萄糖的结构简式:C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3水解:CO32-+2H2O?H2CO3+2OH- | |
| B. | 用惰性电极电解饱和NaCl溶液:2Cl-+2H2O $\frac{\underline{\;电解\;}}{\;}$ Cl2↑+H2↑+2OH- | |
| C. | FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 等体积等物质的量浓度的Ca(HCO3)2与NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 与相同浓度盐酸反应的快慢:Na2CO3>NaHCO3 | |
| C. | 106gNa2CO3和84gNaHCO3分别与过量盐酸反应,放出CO2质量:Na2CO3>NaHCO3 | |
| D. | Na2CO3 和NaHCO3均可与澄清石灰水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 52.4% | B. | 30% | C. | 70% | D. | 47.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl 在同浓度的 CaCl2和 NaCl 溶液中的溶解度相同 | |
| B. | 0.1 mol?L-1 的 Na2S 溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 含有 NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | pH=4.5 的番茄汁中 c(H+) 是 pH=6.5 的牛奶中 c(H+)的 100 倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L 氢气含有氢分子个数为NA | |
| B. | 标准状况下,11.2 L 水含有水分子个数为0.5NA | |
| C. | 1L 0.3mol•L-1Na2SO4 溶液中,含有Na+和SO42- 总数为0.6NA | |
| D. | 18g水含有电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com