
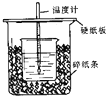
 (1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:
(1)在如图所示的装置中,50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过测定该反应过程中所放出的热量可计算中和热.回答下列问题:| 实验序号 | A | B | C |
| 加入试剂 | KMnO4、H2C2O4 | KMnO4、H2C2O4 1gMnSO4粉末 | KMnO4、H2C2O4 1gNa2SO4粉末 |
| 完全褪色时间/s | 116 | 6 | 117 |
分析 (1)①根据量热计的构造来判断该装置的缺少仪器;
②根据弱电解质电离吸热分析;
(2)①由题意可知探究后一阶段褪色速度明显加快的原因;根据实验 B、C的区别加入的分别是MnSO4和Na2SO4,阳离子不一样,反应速率不同;
②设计对比实验:取一支试管,向其中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,然后放入冰水混合物中,观察颜色变化时间;
(3)①根据滴定操作方法判断使用的仪器,然后写出还缺少的仪器名称;
②反应中有碘单质参与,碘单质遇到淀粉显示蓝色,据此判断指示剂;
③根据反应2Na2S2O3+I2═Na2S4O6+2NaI及题中数据计算出碘单质的含量;
解答 解:(1)①由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
②一水合氨为弱碱,电离过程为吸热过程,所以用氨水代替NaOH溶液反应,反应放出的热量小于中和热数值;
故答案为:偏小;
(2)由题意可知探究后一阶段褪色速度明显加快的原因;根据实验 B、C的区别加入的分别是MnSO4和Na2SO4,阳离子不一样,前者速率快,后者基本不变,由此可知Mn2+作催化剂,加快反应速率;
故答案为:探究后一阶段褪色速度明显加快的原因;Mn2+作催化剂,加快反应速率;
②取一支试管,向其中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,然后放入冰水混合物中,观察颜色变化时间;
故答案为:取一支试管,向其中各加入4mL0.01mol•L-1KMnO4酸性溶液和2mL0.1mol•L-1H2C2O4溶液,然后放入冰水混合物中,观察褪色时间;
(3)①H2S2O3是一种弱酸,则硫代硫酸钠溶液显示碱性,滴定操作中,使用的玻璃仪器有:锥形瓶、烧杯和碱式滴定管,还缺少碱式滴定管,
故答案为:碱式滴定管;
②碘单质遇到淀粉显示蓝色,该滴定中有碘单质的参与,可以使用淀粉作为指示剂,
故答案为:淀粉;
③用c mol•L-1的Na2S2O3标准液滴定,消耗VmLNa2S2O3溶液,消耗硫代硫酸钠的物质的量为:cmol/L×0.001VL=0.001cVmol,
根据反应2Na2S2O3+I2═Na2S4O6+2NaI可知,反应后的溶液中含有碘单质的物质的量为:0.001cVmol×$\frac{1}{2}$=0.0005cVmol,碘单质的质量为:254g/mol×0.0005cVmol=0.127cvg,反应后的溶液中的含碘量为:$\frac{0.127cVg}{0.02L}$=6.35cVg/L,
故答案为:6.35cV.
点评 本题考查了中和热测定、外界条件对反应速率的影响、探究物质组成与含量的方法,题目难度中等,涉及影响化学反应速率的因素、滴定的操作方法及计算等知识,试题培养了学生的分析、理解能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:选择题

| A. | 图1表示0.1000mol•L-1NaOH溶液滴定20.00ml 0.1000 mol•L-1醋酸溶液得到滴定曲线 | |
| B. | 图2所示在H2S溶液导电性实验中,曲线可确定通入的气体X为Cl2 | |
| C. | 图3在其它条件不变时,2SO2(g)+O2(g)?2SO3(g)转化关系中,纵坐标表示O2的转化率 | |
| D. | 由图4所示曲线可知,酶催化比化学催化的效果好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在淀粉与稀硫酸共热后的溶液中,滴加银氨溶液,检验水解产物中的葡萄糖 | |
| B. | 纤维素在人体内可水解生成葡萄糖,进而被氧化为二氧化碳和水,释放能量 | |
| C. | 油脂的水解在碱性条件下可生产肥皂,在酸性条件下生成甘油和高级脂肪酸 | |
| D. | 蛋白质水解的最终产物是氨基酸;遇重金属盐则发生盐析,稀释后仍能溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向蛋白质溶液中加饱和硫酸铵溶液,蛋白质析出,如再加水也不溶解 | |
| B. | 蛋白质溶液中蛋白质分子能通过滤纸,但不能通过半透膜 | |
| C. | 浓硝酸溅在皮肤上,能使皮肤呈黄色是由于蛋白质和浓硝酸发生颜色反应 | |
| D. | 重金属盐能使蛋白质变性,吞服钡餐不会引起中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质水解的最终产物都是α-氨基酸 | |
| B. | 臭氧可用于自来水的消毒,是由于臭氧具有强的氧化性 | |
| C. | 工业上生产氨气时可以用分离出氨气的方法提高转化率,是利用氨易液化的性质 | |
| D. | 氧化铝能与氢氧化钠溶液反应,又能与盐酸反应,是因为氧化铝是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a=b | C. | a<b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热的Na2CO3溶液去除油污:CO32-+H2O═HCO3-+OH- | |
| B. | 用FeS去除废水中的Hg2+:Hg2++S2-═HgS↓ | |
| C. | 用催化法处理汽车尾气中的CO和NO:CO+NO$\frac{\underline{\;催化剂\;}}{\;}$C+NO2 | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2O?Al(OH)3(胶体)+3H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com