
| A. | 12g金刚石晶体中含有的C-C的数目为2NA | |
| B. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 5.6gFe与足量的水蒸气完全反应,转移电子的数目为0.2NA | |
| D. | 标准状况下,22gCO2气体中含有的σ键和π键的数目均为2NA |
分析 A、依据n=$\frac{m}{M}$计算物质的量结合金刚石中1mol金刚石中含有2molC-C键分析;
B、ClO-是弱酸根,在溶液中会水解;
C、铁与水蒸气反应生成的是四氧化三铁;
D、求出二氧化碳的物质的量,然后根据1mol二氧化碳中含2molσ键和2molπ键来计算.
解答 解:A、12g金刚石晶体物质的量=$\frac{12g}{12g/mol}$=1mol,结合金刚石中1mol金刚石中含有2molC-C键分析,1mol金刚石含有碳碳单键数为2NA,故A正确;
B、ClO-是弱酸根,在溶液中会水解,故个数小于NA个,故B错误;
C、5.6g铁的物质的量为0.1mol,铁与水蒸气反应生成四氧化三铁,四氧化三铁中铁元素的平均化合价为+$\frac{8}{3}$,则0.1mol铁完全反应失去电子不是0.2mol,故C错误;
D、22g二氧化碳的物质的量为0.5mol,而1mol二氧化碳中含2molσ键和2molπ键,故0.5mol二氧化碳中含1molσ键和1molπ键,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
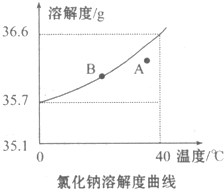 根据氯化钠的溶解度曲线,完成下列问题.
根据氯化钠的溶解度曲线,完成下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| B. | 新型生物柴油和矿物油主要化学成分相同 | |
| C. | “洁厕灵”有效成分为盐酸,与漂白粉混合使用效果更佳 | |
| D. | 用银器盛放鲜牛奶,溶入的极微量的银离子,可杀死牛奶中的细菌,防止牛奶变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:
亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L NaHCO3溶液中含有0.1NA个HCO${\;}_{3}^{-}$ | |
| B. | 78gNa2O2与足量CO2反应,转移电子数为NA | |
| C. | 100℃时,1L pH=1的硫酸溶液中,含有0.05NA个SO42- | |
| D. | 常温常压下,4g CH4含NA个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
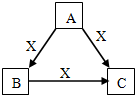 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如右图.请针对以下三种情况不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如右图.请针对以下三种情况不同情况回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com