
| A. | 硫酸工业中涉及的3步反应都为氧化还原反应 | |
| B. | 由反应:H2S+Cl2═S↓+2HCl可知,还原性:Cl2>S | |
| C. | 如用NaOH溶液来吸收尾气中的SO2,只能生成一种盐 | |
| D. | 常温下,铝质容器或铁质容器可储运浓硫酸和浓硝酸 |
分析 A.利用硫铁矿高温煅烧生成二氧化硫,再发生催化氧化生成三氧化硫,三氧化硫再与水反应生成硫酸,根据化合价是否变化判断;
B.根据H2S+Cl2═S↓+2HCl可知,Cl2为氧化剂,S为氧化产物判断;
C.NaOH溶液来吸收少量的SO2生成Na2SO3,吸收过量的SO2生成NaHSO3;
D.常温下浓硫酸或浓硝酸能使铝或铁钝化.
解答 解:A.工业制硫酸利用硫铁矿高温煅烧生成二氧化硫,再发生催化氧化生成三氧化硫,三氧化硫再与水反应生成硫酸,第3步没有化合价变化,不属于氧化还原反应,故A错误;
B.H2S+Cl2═S↓+2HCl可知,Cl2为氧化剂,S为氧化产物,则氧化性:Cl2>S,故B错误;
C.NaOH溶液来吸收少量的SO2生成Na2SO3,吸收过量的SO2生成NaHSO3,所以用NaOH溶液来吸收尾气中的SO2,可能生成2种盐,故C错误;
D.常温下浓硫酸或浓硝酸能使铝或铁钝化,所以常温下铝质容器或铁质容器可储运浓硫酸或浓硝酸,故D正确;
故选:D.
点评 本题考查了金属元素及其化合物的性质,注重了基础知识的考查,本题难度不大


科目:高中化学 来源: 题型:选择题
| A. | CO2+2NaOH═Na2CO3+H2O | B. | CO2+C(红热)═2CO | ||
| C. | CO2+Ca(OH)2═CaCO3+H2O | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和稀硝酸反应 Cu+4H++NO3-=Cu2++2H2O+NO↑ | |
| B. | 碳酸氢钠和过量的澄清石灰水反应 2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32- | |
| C. | Fe投入盐酸中 2Fe+6H+=2Fe3++3H2↑ | |
| D. | 氢氧化铝溶于氢氧化钠溶液 Al(OH)3+OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人体中含量位于前6名的元素依次是:氢、氧、X、氮、钙、磷.根据要求用以上元素完成下列填空:
人体中含量位于前6名的元素依次是:氢、氧、X、氮、钙、磷.根据要求用以上元素完成下列填空: ;该分子的空间构型为正四面体结构.
;该分子的空间构型为正四面体结构.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
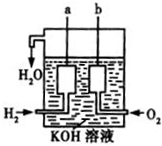 氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol请回答下列问题:
氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)═2H2O(l)△H=-572kJ/mol请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱溶液的pH大于7,Ba(OH)2是碱,所以氢氧化钡溶液的pH大于7 | |
| B. | 点燃H2和O2混合气体可能爆炸,所以点燃H2与CO的混合气体也可能爆炸 | |
| C. | 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| D. | 蜡烛燃烧生成CO2和H2O,所以蜡烛组成里一定含有碳元素、氢元素和氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2K(s)+2H2O(1)═2KOH(aq)+H2(g)△H1,2Na(s)+2H2O(1)═2NaOH(aq)+H2(g)△H2,则△H1>△H2 | |
| B. | Mg(s)+2HCl(aq)═MgCl2(aq)+H2(g)△H1,Ca(s)+2HCl(aq)═CaCl2(aq)+H2(g)△H2,则△H1>△H2 | |
| C. | H2(g)+Cl2(g)═2HCl(g),H2(g)+Br2(g)═2HBr(g)△H2,则△H1>△H2 | |
| D. | 2Fe(s)+3Br2(g)═2FeBr3(s)△H1,2Fe(s)+3Cl2(g)═2FeCl3(s)△H2,则△H1<△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com