
 AlO
AlO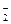 。
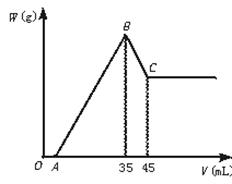
。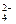 )。又据元素守恒,n(Na+)=n(NaOH)="10" mol·L-1×0.035 L,n(SO
)。又据元素守恒,n(Na+)=n(NaOH)="10" mol·L-1×0.035 L,n(SO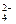 )=n(H2SO4)=c(H2SO4)×0.1,所以c(H2SO4)="1.75 " mol·L-1。
)=n(H2SO4)=c(H2SO4)×0.1,所以c(H2SO4)="1.75 " mol·L-1。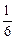 n(NaOH)=
n(NaOH)=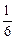 ×(10 mol·L-1×0.03 L)="0.05" mol
×(10 mol·L-1×0.03 L)="0.05" mol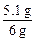 ×100%=85%
×100%=85%

科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 下图所示各物质均由短周期元素组成,部分反应的产物略去。A的摩尔质量为65g/mol,B、F为金属单质,D、H、G为无色气态非金属单质,C、K、L和X都属于氧化物,E、J、M均为重要的化工产品。
下图所示各物质均由短周期元素组成,部分反应的产物略去。A的摩尔质量为65g/mol,B、F为金属单质,D、H、G为无色气态非金属单质,C、K、L和X都属于氧化物,E、J、M均为重要的化工产品。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.③④ | D.④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①③④⑤⑥ | B.①②③④⑤ | C.①④⑤⑥ | D.①④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.三种金属单质放置在空气中均只生成氧化物 |
| B.保存Fe2(SO4)3溶液时需要加入铁钉 |
| C.无需另选试剂就可以鉴别浓度均为0.1mol?L-1的三种金属的硫酸盐 |
| D.三种金属的活泼性:Al>Cu>Fe |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.5mol/L稀硝酸 | B.2.0mol/L氢氧化钡溶液 |
| C.2.0mol/L稀盐酸 | D.18.4mol/L硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com