
| 选项 | 实验操作 | 实验现象 |
| A | 将盛有CH4与Cl2的集气瓶放在光亮处一段时间 | 气体颜色变浅,瓶内壁附有油状物 |
| B | 将乙烯在空气中点燃 | 火焰呈蓝色并伴有黑烟 |
| C | 向盛有苯的试管中加入几滴酸性KMnO4溶液,充分振荡 | 液体分层,溶液紫色褪去 |
| D | 将蔗糖溶液与稀硫酸混合水浴加热,取反应后的溶液少量,加入几滴新制的Cu(OH)2悬浊液加热 | 出现砖红色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯气和甲烷发生取代反应氯代烷;
B.乙烯燃烧产生明亮的火焰伴有黑烟;
C.苯不与高锰酸钾反应,苯不溶于水且密度小于水;
D.蔗糖水解反应后的溶液中含有硫酸,葡萄糖与氢氧化铜浊液的反应应在碱性条件下.
解答 解:A.氯气和甲烷发生取代反应,消耗氯气,所以颜色变浅;反应生成的氯代烷是油状有机物不溶于水,故A正确;
B.乙烯燃烧产生明亮的火焰伴有黑烟,故B错误;
C.苯不与高锰酸钾反应,苯不溶于水且密度小于水,所有现象是:溶液分层,下层呈现紫红色,故C错误;
D.蔗糖水解反应后的溶液中含有硫酸,直接加入新制的氢氧化铜不会出现砖红色,故D错误;
故选A.
点评 本题考查较为综合,涉及甲烷的取代、乙烯的燃烧、苯的性质以及蔗糖的水解等知识,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力和评价能力的考查,注意把握实验操作要点,结合物质的性质综合考虑,难度中等.


科目:高中化学 来源: 题型:解答题
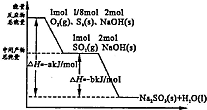 为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成份SO2)来制取石膏(CaSO4•2H2O)和过二硫酸钠(Na2S2O8).设计简要流程如下:
为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成份SO2)来制取石膏(CaSO4•2H2O)和过二硫酸钠(Na2S2O8).设计简要流程如下: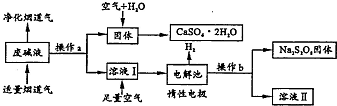
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、蛋白质、油脂均是天然高分子化合物 | |
| B. | 铜矿石在细菌作用下可直接转化为单质铜,这个过程叫生物炼铜 | |
| C. | 氟氯烃的肆意排放会加速臭氧层的破坏,使大气层中的紫外线增强 | |
| D. | 凯库勒的“基团理论”尽管存在缺陷,但仍对有机化学的发展起到了巨大的推动作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 铜、铁、铝都是日常生活中常见的金属,具有广泛用途.请回答:
铜、铁、铝都是日常生活中常见的金属,具有广泛用途.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时NaTi2(PO4)3在正极发生还原反应 | |
| B. | 充电过程中阳极反应式为:2NaNiFeⅢ(CN)6+2Na++2e-=2Na2NiFeⅡ (CN)6 | |
| C. | 放电时负极材料中的Na+脱离电极进入溶液,同时溶液中的Na+嵌入到正极材料中 | |
| D. | 该电池在较长时间的使用过程中电解质溶液中Na+的浓度基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.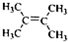 .
.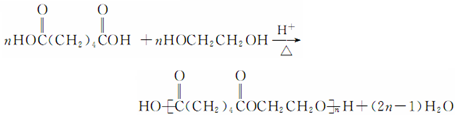 .
.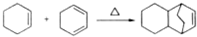 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
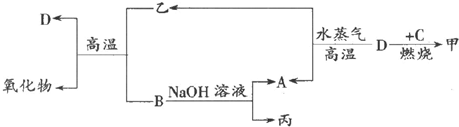
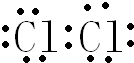 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com