
| A. | 使甲基橙变红色的溶液中:Na+、Fe2+、MnO4-、AlO2- | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1×10-12mol/L,的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | PH=0的溶液中:Al3+、Ag(NH3)2+、I-、SO42- | |
| D. | 加入Mg能放出H2的溶液中:Ca2+、NH4+、ClO-、NO3- |
分析 A.使甲基橙变红色的溶液呈酸性;
B.$\frac{{K}_{w}}{c({H}^{+})}$=1×10-12mol/L的溶液中呈酸性;
C.PH=0的溶液呈酸性;
D.加入Mg能放出H2的溶液呈酸性.
解答 解:A.使甲基橙变红色的溶液呈酸性,酸性条件下Fe2+、MnO4-发生氧化还原反应,且AlO2-不能大量共存,故A错误;
B.$\frac{{K}_{w}}{c({H}^{+})}$=1×10-12mol/L的溶液中呈酸性,酸性条件下离子之间不发生任何反应,可大量共存,故B正确;
C.PH=0的溶液呈酸性,酸性条件下Ag(NH3)2+不能大量共存,故C错误;
D.加入Mg能放出H2的溶液呈酸性,酸性条件下ClO-不能大量共存,故D错误.
故选B.
点评 本题考查离子共存,为高频考点,把握习题中的信息及离子之间的反应为解答本题的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.742吨 | B. | 0.85吨 | C. | 0.875吨 | D. | 1吨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的CH3COOH溶液中,由水电离出来的c(H+)=1.0×10-4mol•L-1 | |
| B. | 物质的量浓度相等的①(NH4)2SO3溶液和②NH4HSO4溶液中c(NH4)+:①<② | |
| C. | pH=3的0.1mol•L-1 NaHC2O4溶液中:c(Na+)>c(HC2O4-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H2CO3)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
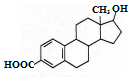
| A. | 该有机物的分子式为C19H22O3 | |
| B. | 该分子中所有碳原子不可能在同一个平面内 | |
| C. | 能发生加成反应、取代反应、水解反应 | |
| D. | 能与Na、NaOH溶液反应,但不能与NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸除去水垢中的碳酸钙:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| C. | 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++OH-+HCO3-═BaCO3↓+2H2O | |
| D. | 向Na2FeO4溶液中加入稀硫酸产生氧气:4FeO42-+20H+═4Fe3++3O2↑+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
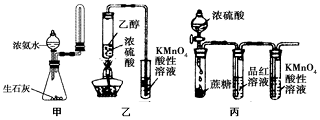
| A. | 实验室用图甲所示装置制取少量氨气 | |
| B. | 为使100ml0.5mol/L的NaNO3溶液物质的量浓度变为1mol/L,可将原溶液加热蒸发掉50ml水 | |
| C. | 利用图乙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化 | |
| D. | 利用图丙装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测得0.10mol/LCH3COOH溶液中存在较多的CH3COOH分子 | |
| B. | 比较等浓度等体积的盐酸、CH3COOH溶液与足量Zn反应生成H2的体积 | |
| C. | 比较等浓度等体积的盐酸、CH3COOH溶液与等量NaOH溶液反应后放出的热量 | |
| D. | 0.10mol/LNH4Cl呈酸性,0.1mol/LCH3COONH4溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| ① | 检验淀粉是否水解生成葡萄糖 | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后新制Cu(OH)2浊液,加热,观察是否有红色沉淀生成 |
| ② | 比较H2CO3,HCN的酸性强弱 | 用pH计测定同温度同浓度的Na2CO3溶液和NaCN溶液的pH,比较pH大小 |
| ③ | 区别植物油和矿物油 | 向植物油和矿物油中分别加入烧碱溶液,加热,冷却后观察是否分层 |
| ④ | 验证CaCO3的溶解度小于CaSO4 | 将浓Na2CO3溶液滴加到CaSO4悬浊液中,充分振荡,过滤、洗涤,向所得固体中滴加盐酸,观察是否有气体生成 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com