
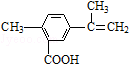
| A. | 在一定条件下,能发生取代、氧化和加聚反应 | |
| B. | 该物质分子中最多可以有11个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与5 mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
分析 由结构可知,分子中含碳碳双键、-COOH,结合烯烃及羧酸的性质来解答.
解答 解:A.含-COOH可发生取代反应,含碳碳双键可发生氧化、加聚反应,故A正确;
B.苯环及双键为平面结构,与苯环直接相连的C原子共面,则最多可以有11个碳原子在同一平面上,故B正确;
C.苯环及双键可与氢气发生加成反应,则1 mol该物质最多可与4 mol H2发生加成反应,故C错误;
D.分子中含11个C、12个H、2个O,1 mol该物质完全氧化最多可消耗1mol×(11+$\frac{12}{4}$-$\frac{2}{2}$)=13 mol氧气,故D正确;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃及羧酸性质的考查,注意选项B为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A. | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B. | 先滴加稀盐酸再滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| C. | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+ |
| D. | 滴加NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L一氧化碳和二氧化碳混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1克氯气与足量的氢氧化钠溶液反应转移的电子数位0.2NA | |
| C. | 92克二氧化氮和四氧化二氮的混合气体中含有的原子总数为6NA | |
| D. | 1.5mol/L氯化钙溶液中含有氯离子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H+十SO42-═BaSO4↓+H2O | |
| B. | 将稀硝酸滴加到氯化银固体上:AgCl+H+═Ag++HCl | |
| C. | 向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3•H2O | |
| D. | 用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
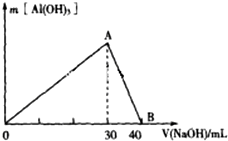 研究工业废弃物的处理和防治具有重要的意义.
研究工业废弃物的处理和防治具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量氨水与氯化铝溶液反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 氢氧化铝溶于稀盐酸中:H++OH-═H2O | |
| C. | 氢氧化铝溶于氢氧化钠溶液:Al(OH)3+OH-═AlO2-+2H2O | |
| D. | 过量氢氧化钠溶液与氯化铝溶液反应:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
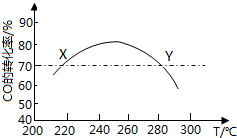 工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )| A. | X、Y两点对应的CO正反应速率相等 | |
| B. | 合成二甲醚的正反应△H>0 | |
| C. | 反应温度应控制在240℃~260℃之间 | |
| D. | 选择合适催化剂,可以提高CO转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
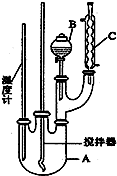
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com