
实验室也可用KMnO4固体和浓盐酸反应制氯气,反应方程式如下:
2KMnO4+16HCl(浓)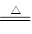 2KCl+2MnCl2+8H2O+5Cl2。
2KCl+2MnCl2+8H2O+5Cl2。
完成下列问题:
(1)该反应中氧化剂是_____________,还原产物是__________________。
(2)若反应中有0.5 mol电子转移,被氧化的HCl的物质的量是多少?参加反应的高锰酸钾质量为多少?
(1)KMnO4 MnCl2
(2)被氧化的的HCl的物质的量有0.15mol,有15.8g KMnO4参加了反应。
【解析】(1)氧化剂是指在反应中得到电子,化合价降低的物质,氧化剂得到电子即被还原成还原产物。根据方程式可知,高锰酸钾中锰的化合价从+7价降低到+2价,所以高锰酸钾是氧化剂,氯化锰是还原产物。
(2)氯化氢在反应中氯原子的化合价从-1价升高到0价,即1molHCl失去1mol电子,所以有0.5 mol电子转移时,被氧化的HCl的物质的量是0.15mol。根据得失电子守恒可知,参加反应的高锰酸钾是0.1mol,质量是0.1mol×158g/mol=15.8g。


科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源:2010年河北省唐山一中高一上学期期中考试化学卷 题型:填空题
(8分)实验室也可用KMnO4固体和浓盐酸反应制氯气,反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
完成下列问题:
(1)该反应中氧化剂是_____________;还原产物是_____________。
(2)若反应中有0.5 mol电子转移,被氧化的HCl的物质的量是多少?有多少克KMnO4参加了反应?
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省六安三中高一上学期期末考试化学试卷(带解析) 题型:计算题
实验室也可用KMnO4固体和浓盐酸反应制氯气,反应方程式如下:
2KMnO4+16HCl(浓)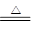 2KCl+2MnCl2+8H2O+5Cl2。
2KCl+2MnCl2+8H2O+5Cl2。
完成下列问题:
(1)该反应中氧化剂是_____________,还原产物是__________________。
(2)若反应中有0.5 mol电子转移,被氧化的HCl的物质的量是多少?参加反应的高锰酸钾质量为多少?
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高一上学期期中考试化学试卷 题型:填空题
(6分)实验室也可用KMnO4固体和浓盐酸反应制氯气,反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
完成下列问题:
(1)该反应中氧化剂是 ,还原剂是 ,氧化产物是 ,还原产物是 。
(2)用双线桥标出该反应的电子得失的方向和数目 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com