
【题目】如图是H2(g)与I2(g)反应生成HI(g)的能量示意图。由图可知

A.该反应是吸热反应
B.1 mol HI(g)分解吸收的热量为Q
C.热化学方程式:H2+I2![]() 2HI+Q
2HI+Q
D.反应物总能量高于生成物总能量
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如下图所示。请填写下列空白:

(1)在该溶液中含有的离子是_____________,物质的量浓度之比为_______________。
(2)所加的淡黄色固体是________________(化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8gCH4共有___mol氢原子,0.1molNH3共有约___个原子,同温同压下,同体积的NH3和H2S气体的质量比为___;同温同压下,同质量的NH3和H2S气体的体积比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲苯苯环上的氢原子被相对分子质量为43的烃基取代,所得一元取代物有_________ 种。
(2)已知二氯苯有3种同分异构体,则四氯苯的同分异构体数目有________种。
(3)某芳香烃的分子式为C8H10,它不能使溴水褪色,但能使酸性KMnO4溶液褪色,该有机物苯环上的一氯代物只有一种,则该烃的结构简式是_____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是一种应用广泛的化工原料。工业上先合成氨气:N2(g)+3H2(g) ![]() 2NH3(g)+Q(Q>0),再进一步制备肼。完成下列填空:
2NH3(g)+Q(Q>0),再进一步制备肼。完成下列填空:

(1)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行试验,所得结果如图所示(其他条件相同),则生产中适宜选择的催化剂是___(填“A”或“B”或“C”),理由是:________________。
(2)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“无法确定”)
反应速率 | 平衡常数K | 氨的体积分数 | |
变化情况 | __ | ____ | ____ |
(3)肼可作为火箭燃料,4gN2H4(g)在NO2气体中燃烧生成氮气和气态水,放出71kJ的热量。写出该反应的化学方程式:________。
(4)氨主要用于生产化肥和硝酸。“十三五”期间,预计我国合成氨产量将保持稳中略增。下图是不同温度和不同压强下,反应达到平衡后,混合物中NH3含量(体积%)的变化情况,己知初始时n(N2):n(H2)=1:3。判断pl、p2压强的大小关系,pl___p2(选填“>”、“<”或“=”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,11.2LCO和CO2混合气体质量为20.4g,下列说法正确的是( )
A.混合气体中CO和CO2的体积比1∶4
B.混合气体中CO和CO2的体积比4∶1
C.混合气体中CO和CO2的质量比为1∶4
D.混合气体中CO和CO2的平均相对分子质量为40.8g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的自然科学。掌握实验方法以及完成化学实验所需要的技能,是学好化学的关键。
(1)正确使用仪器、按正确的步骤进行实验都是实验成功的关键。请回答:
①分液时,分液漏斗中的液体很难滴下,原因是:_____________________________。
②容量瓶使用之前,必须进行的操作为:___________________________。
③可燃性气体与空气混合点燃可能会爆炸,所以可燃性气体点燃前应先________________。
(2)欲测定某铝铜合金的组成,进行了如下实验:称取粉末状样品1.0克,加入某浓度的盐酸10 mL ,充分反应后,收集到标准状况下气体224 mL ;然后,再往样品中加入同浓度的盐酸10 mL ,充分反应后又收集到标准状况下气体112 mL 。求:
①所取盐酸的物质的量浓度为________________。
②样品中铝的质量分数为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上烟气脱氮的原理![]()
(1)该反应化学平衡常数K的表达式为____________。温度升高,K值___________(选填“增大”、“减小”、“不变”)。如果平衡常数K值增大,对_______(填“正反应”或“逆反应”)的速率影响更大。
(2)若反应在恒容条件下进行,能说明反应已经达到平衡状态的是______(填序号)
a.容器内混合物的质量不变 b.容器内气体的压强不变
c.反应消耗0.5mol NO的同时生成1mol N2 d.![]() 的浓度不变
的浓度不变
(3)向2 L密闭容器中加入反应物,10 min后达到平衡,测得平衡时气体的物质的量增加了0.2mol,则用![]() 表示的平均反应速率为__________。
表示的平均反应速率为__________。
(4)如图是P1压强下NO的转化率随反应时间(t)的变化图,请在图中画出其他条件不变情况下,压强为![]() 下NO的转化率随反应时间变化的示意图。
下NO的转化率随反应时间变化的示意图。
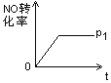 ______
______
(5)工业合成氨的反应温度选择500℃左右的原因是_______________。
(6)写出反应物中的氨气的电子式______;其空间构型为______;它常用来生产化肥![]() 。
。![]() 溶液显__________性;常温下将等体积等浓度的氨水和
溶液显__________性;常温下将等体积等浓度的氨水和![]() 溶液混合,pH>7,溶液中
溶液混合,pH>7,溶液中![]() 浓度由大到小的关系是_______________。
浓度由大到小的关系是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应X(g)+3Y(g)![]() 2Z(g) △H的能量变化如下图所示。下列说法正确的是
2Z(g) △H的能量变化如下图所示。下列说法正确的是
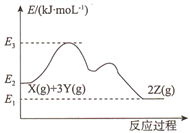
A. △H= E2- E1 B. 更换高效催化剂,E3不变
C. 恒压下充入一定量的氦气n(Z)减少 D. 压缩容器,c(X)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com