
 (1)写出基态镍原子的价电子排布图
(1)写出基态镍原子的价电子排布图 .
. )分子中2号碳原子的杂化方式为sp2杂化;与CS2互为等电子体的离子是SCN-(写一种).
)分子中2号碳原子的杂化方式为sp2杂化;与CS2互为等电子体的离子是SCN-(写一种).分析 (1)Ni原子在周期表中的位置为第四周期,第VIII族;
(2)丙酮分子中2号碳原子为羰基碳原子,是平面构型,根据杂化轨道理论判断,等电子体是指原子数目相同,价电子数目也相同的粒子;
(3)配合物外界可以完全电离,内界不电离,根据反应关系确定反应的量,根据VSEPR理论和电负性差异解释H2O和H2S的键角差异;
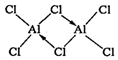
(4)①立方晶胞中,顶点粒子占$\frac{1}{8}$,面心粒子占$\frac{1}{2}$,内部粒子为整个晶胞所有,据此解答;
②由该晶胞可以看出,与金刚石晶胞相似,所以讲晶胞内的四个黑点相互连接,可以组成一个正四面体形;
③结合Cl原子周围等径的Cl原子的排布解答,在图中的晶胞中,Cl原子周围等径且最近的原子有8个,考虑到晶胞不是孤立的个体,下面还有晶胞,下面一个晶胞有4个,一共是12个;
④根据晶胞密度公式$ρ=\frac{z{M}_{r}}{{N}_{A}V}$解答,其中z为一个晶胞粒子数,Mr为一个粒子的相对质量,V为一个晶胞的体积.
解答 解:(1)Ni原子在周期表中的位置为第四周期,第VIII族,在Co的后面一个元素,其价电子排布式为3d84s2,则其价电子排布图为: .故答案为:
.故答案为: .
.
(2)根据图示,丙酮分子中2号碳原子为羰基碳原子,是平面构型,根据杂化轨道理论,2号C原子的杂化方式应为sp2杂化;求等电子体粒子,通常采用上下左右平移元素,同时调电子数的方法求解,所以与CS2互为等电子体的阴离子,需注意求解的是阴离子,则有SCN-(或$OC{N}^{-},CN{O}^{-},{N}_{3}^{-}$等).故答案为:sp2杂化,SCN-(或$OC{N}^{-},CN{O}^{-},{N}_{3}^{-}$等).
(3)配合物外界可以完全电离,内界不电离,对于0.1mol[Cr(H2O)5Cl]Cl2•H2O的水溶液,可以完全电离出0.2molCl-,也就可以与0.2mol硝酸银反应生成0.2molAgCl沉淀;H2O分子的键角比H2S分子的键角大,O和S均为氧族元素,O的电负性比S大,但O的半径比S小,二者含有相同的价电子,半径小的O原子电子的斥力较大,而根据VSEPR理论,孤电子对斥力大于键电子对斥力,因此H2O的键角大些.故答案为:0.2,氧的原子半径比硫小,电负性比硫大,水分子中成键电子对更靠近中心原子,相互排斥作用大,键角大.
(4))①立方晶胞中,顶点粒子占$\frac{1}{8}$,面心粒子占$\frac{1}{2}$,内部粒子为整个晶胞所有,因此一个晶胞中,Cu的数目为4,Cl的数目为$8×\frac{1}{8}+6×\frac{1}{2}=4$,则该晶体的化学式为CuCl;
②由该晶胞可以看出,与金刚石晶胞相似,所以讲晶胞内的四个黑点相互连接,可以组成一个正四面体形.故答案为:正四面体形.
③晶胞不应作为孤立体系而存在,周围有无数晶胞重叠,从底心的Cl看出,周围等径且最近的原子有8个,下面一个晶胞有4个,因此在它周围等径且最近的Cl有12个.故答案为:12.
④取1mol晶胞,则有NA个晶胞,设晶胞边长为acm,则一个晶胞的体积为${V}_{0}={a}^{3}$cm3一个晶胞中含有4个Cu和4个Cl,则1mol晶胞的质量为m=4×64+4×35.5=4×99.5g,则晶胞的密度为$ρ=\frac{m}{{N}_{A}{V}_{0}}=\frac{4×99.5}{{N}_{A}{a}^{3}}g/c{m}^{3}$,所以晶胞的边长$a=\root{3}{\frac{4×99.5}{ρ×{N}_{A}}}$,CuCl的晶胞与金刚石晶胞相似,左下角附近的一个Cu与周围四个Cl形成一个正四面体,金刚石晶胞中,C原子以sp3杂化与周围C原子连接,根据杂化轨道理论键角公式,键角应为$cosθ=\frac{-\frac{1}{4}}{1-\frac{1}{4}}=-\frac{1}{3}$,设Cu-Cl原子的最短距离为x,这个最短距离就是正四面体的Cu-Cl原子的键长,根据几何关系,左下角顶点的Cl与左面心的Cl原子间的距离应为$\frac{\sqrt{2}}{2}a$,由余弦定理,$cosθ=\frac{{x}^{2}+{x}^{2}-(\frac{\sqrt{2}}{2}a)^{2}}{2•x•x}=-\frac{1}{3}$,解得$x=\frac{\sqrt{3}}{4}a$,由于$a=\root{3}{\frac{4×99.5}{ρ×{N}_{A}}}$,所以$x=\frac{\sqrt{3}}{4}×\root{3}{\frac{4×99.5}{ρ×{N}_{A}}}cm$=$\frac{\sqrt{3}}{4}×\root{3}{\frac{4×99.5}{{N}_{A}×ρ}}×1{0}^{10}pm$.故答案为:$\frac{\sqrt{3}}{4}×\root{3}{\frac{4×99.5}{{N}_{A}×ρ}}×1{0}^{10}$.
点评 本题考查物质结构知识,包括核外电子排布式,排布图,杂化轨道理论,粒子空间构型的判断,等电子体原理,晶胞计算.最后一问难度较大,需观察到与金刚石晶胞的相似性,注意知识的迁移,需结合大学化学的杂化轨道理论键角公式和余弦定理求解,需要一定的几何知识,能力要求很高,难度较大.本题整体难度中等,考查知识点综合,是中档题.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ | |
| B. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| C. | pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:C(Na+)+c(H+)=c(OH-)+c(HC2O4-) | |
| D. | pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 乙电极附近溶液的pH减小 | |
| B. | 电极丁的反应式为:MnO42--e-═MnO4- | |
| C. | KOH溶液的质量分数:c%>a%>b% | |
| D. | 导线中有2 mol电子通过时,理论上有2 mol K+移入阴极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟化氢的电子式: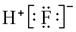 | B. | 白磷分子的球棍模型: | ||
| C. | CO2分子的球棍模型: | D. | K+离子的结构示意图: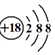 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:PO>Te | B. | 为非金属元素 | ||
| C. | ${\;}_{84}^{209}$PO的中子数为125 | D. | 在周期表中第六周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高正化合价和最低负化合价的代数和为4的短周期元素 | |
| B. | 没有正化合价的元素 | |
| C. | 没有负化合价的元素 | |
| D. | 最高正化合价与最低负化合价绝对值相等的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com