
 胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如右图所示的实验结果示意图.以下说法正确的是CD(填标号).
胆矾晶体(CuSO4•5H2O)中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合.某兴趣小组称取2.500g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如右图所示的实验结果示意图.以下说法正确的是CD(填标号).分析 2.500g胆矾的物质的量为0.01mol,102~113℃之间失去结晶水质量为2.5g-2.14g=0.36g,失去结晶水为$\frac{0.36g}{18g/mol}$=0.02mol,113~258℃之间失去结晶水质量为2.14g-1.78g=0.36g,失去结晶水为0.02mol,258℃以上失去结晶水质量为1.78g-1.6g=0.18g,失去结晶水为0.01mol.
A.胆矾晶体中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合,所以只有氢键断裂,说明失去一个结晶水;
B.由计算可知,结晶水分3个阶段失去;
C.根据CuSO4、结晶水物质的量确定化学式;
D.因为固体质量就是分三次降低的,而三次温度变化值不同,所以克服的作用力大小不同.
解答 解:2.500g胆矾的物质的量为0.01mol,102~113℃之间失去结晶水质量为2.5g-2.14g=0.36g,失去结晶水为$\frac{0.36g}{18g/mol}$=0.02mol,113~258℃之间失去结晶水质量为2.14g-1.78g=0.36g,失去结晶水为0.02mol,258℃以上失去结晶水质量为1.78g-1.6g=0.18g,失去结晶水为0.01mol.
A.胆矾晶体中4个水分子与铜离子形成配位键,另一个水分子只以氢键与相邻微粒结合,所以只有氢键断裂,说明失去一个结晶水,而105℃的过程中失去结晶水占总的$\frac{2}{5}$,故不只有氢键断裂,还有配位键断裂,故A错误;
B.胆矾晶体中形成配位键的4个水分子分3个阶段失去,故B错误;
C.120℃时,剩余固体中CuSO4与结晶水的物质的量之比为0.01mol:(0.05mol-0.04mol)=1:1,故化学式为CuSO4•H2O,故C正确;
D.因为固体质量就是分三次降低的,而三次温度变化值不同,所以晶体中的水分子所处化学环境可以分为3种,故D正确;
故选:CD.
点评 本题考查化学图象有关计算,涉及化学键问题,侧重考查学生计算分析推理能力,难度中等,有利于基础知识应用.


科目:高中化学 来源: 题型:选择题
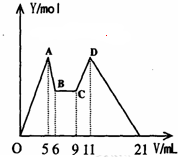 在氯化铝和氯化镁的混合溶液中,向其中滴加a mLC1mol•L-1 NaOH之后,改成滴加C2mol•L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示.则所加入NaOH溶液的体积为( )
在氯化铝和氯化镁的混合溶液中,向其中滴加a mLC1mol•L-1 NaOH之后,改成滴加C2mol•L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示.则所加入NaOH溶液的体积为( )| A. | 9mL | B. | 7.5mL | C. | 7ml | D. | 6mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
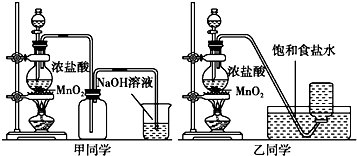
| 实验序号 | 实验操作 | 现象 | 结论 |
| ① | 加品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| ② | 加入NaHCO2粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z的氢化物是同主族简单氢化物中沸点最低的一种 | |
| B. | 非金属性:Z>Y>X | |
| C. | XY2中各原子最外层均满足8电子结构 | |
| D. | X、Y、Z的氢化物中化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
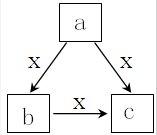 X为一种常见气体(常温下),a,b,c是中学化学常见物质,均由常见元素组成,转化关系如图所示,下列说法不正确的是( )
X为一种常见气体(常温下),a,b,c是中学化学常见物质,均由常见元素组成,转化关系如图所示,下列说法不正确的是( )| A. | 若a、b、c焰色反应均呈黄色,其水溶液均为碱性,则a中可能既含有离子键又含有共价键 | |
| B. | 若X为O2,a为一种固态单质,则c可能为CO2或SO2 | |
| C. | 若b为固态非金属单质,X为气体单质,且b与X所含元素同主族,则a→b、b→c、a→c的反应均为氧化还原反应 | |
| D. | 若a、b、c均含有同一种非金属,且X的水溶液呈碱性,则c可能受热易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=5时,c(Na+)+c(H+)=c(OH-)+c(H2C2O4)+2c(C2O42-) | |
| B. | 当a=10时,c(Cl-)+c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | 当a=15时,c(H2C2O4)+c(HC2O4-)=0.04mol•L-1 | |
| D. | 当a=20时,c(Na+)=c(H+)>c(HC2O4-)>c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验目的 | 操作或现象 |
| A | 检验甲酸溶液中是否含有甲醛 | 向溶液中加入氢氧化钠溶液,中和甲酸后,加入新制的氢氧化铜加热,有红色沉淀产生 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 检验蔗糖是否已水解 | 向蔗糖溶液中加入4滴稀硫酸,煮沸几分钟,冷却,再加入银氨溶液,水浴加热 |
| D | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向上层清液中加稀HNO3酸化,再滴加AgNO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com