
| A.CO32—与H+、Ca2+不能大量共存 | B.H2CO3的酸性比HClO强,比H2SO3弱 |
| C.H2SO3是一种强酸 | D.H2CO3、HClO都属于弱酸 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.c(OH—)·c(NH4+)/c(NH3·H2O) | B.c(NH3·H2O)/c(OH—) |
| C.c(H+)和c(OH_)的乘积 | D.OH—的物质的量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
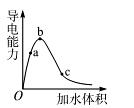
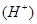 由小到大的顺序是 。
由小到大的顺序是 。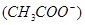 增大,c
增大,c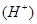 减少,可采取的措施是(至少写出三种方法)
减少,可采取的措施是(至少写出三种方法) 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH3·H2O ="=" NH4++OH- | B.CuCl2 ="=" Cu2++Cl- |
| C.H2CO3 ="=" 2H++CO32- | D.Ba(OH)2 ="=" Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Al2(SO4)3 ="=" 2Al+3 + 3SO4-2 | B.Na2CO3==Na2+ + CO32- |
| C.NaOH ="=" Na+ + OH- | D.NaHCO3 ==Na+ + H+ + CO32- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.1mol/L该酸溶液的pH约为3 |
| B.HCN水溶液中, c(H+)> c(OH-) |
| C.10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应 |
| D.HCN易溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.5 mol/L MgSO4溶液 | B.0.5 mol/L盐酸 |
| C.0.5 mol/L的CH3COOH溶液 | D.0.5 mol/L NH4Cl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com