
已知:在实验中,常常利用高沸点酸制低沸点酸。以六水合氯化镁(MgCl2·6H2O)为原料制备无水氯化镁。已知MgCl2·6H2O晶体在空气中加热时,释放出部分结晶水,同时生成Mg(OH)Cl或MgO;在干燥HCl气流中加热,能制得无水MgCl2。
可选用药品:MgCl2·6H2O晶体、NaCl(s)、KClO3(s)、MnO2、浓H2SO4、浓盐酸、稀NaOH溶液。
 仪器如图所示(装置可重复使用)。回答下列问题:
仪器如图所示(装置可重复使用)。回答下列问题:
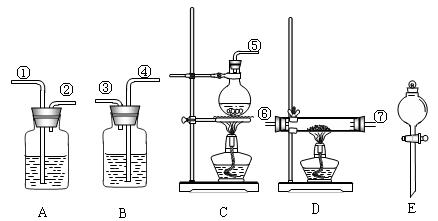
(1)组装氯化氢气体发生器,应选用的仪器(用编号A、B等填入)是 ,
有关的化学方程式是 。
(2)按气流方向,其余装置的连接顺序(用数字①、②等填入)是:
( )→( )( )→ ( )( )→( )( )
(3)各装置中应放的药品: B.______,D.______,E.______。
(4)B装置的作用是_________________。
(5)从实验安全角度考虑,上述所给药品和仪器设计的实验存在不足,请你提出修改建议: 。
(1)C、E(2分) 2 NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑(3分)
Na2SO4+2HCl↑(3分)
(2)⑤ ① ② ⑥ ⑦ ④ ③(3分)(3)稀NaOH MgCl2·6H2O 浓H2SO4(3分)
(4)吸收多余HCl气体,防止环境污染(2分)
(5)在B中加入一定量的四氯化碳浸没导管口或用盛装碱石灰的干燥管代替B装置或在B的进气管口接一下倒置的漏斗,接近液面(2分)
(1)实验室可以利用氯化物固体与浓硫酸反应制备氯化氢,根据提供的仪器知,C装置用于固体与液体,加热制气体;(2)氯化镁晶体失去时发生水解,避免水解,在干燥氯化氢气体中加热氯化镁晶体,多余的氯化氢气体在吸附,避免污染环境,所以,仪器连接顺序为C![]() A
A![]() E
E![]() B(3)A中装浓硫酸用于干燥,B中装氢氧化钠溶液用于吸收尾气;C中装氯化钠,D中装氯化镁晶体,F中装浓硫酸,用于制氯化氢(4)B装置吸收氯化氢,避免氯化氢排入空气中,污染环境(5)氯化氢极易溶于水,不能直接通入氢氧化钠溶液中,要防倒吸。
B(3)A中装浓硫酸用于干燥,B中装氢氧化钠溶液用于吸收尾气;C中装氯化钠,D中装氯化镁晶体,F中装浓硫酸,用于制氯化氢(4)B装置吸收氯化氢,避免氯化氢排入空气中,污染环境(5)氯化氢极易溶于水,不能直接通入氢氧化钠溶液中,要防倒吸。


科目:高中化学 来源: 题型:阅读理解
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
现 象 |
| ① | 第一份CuSO4溶液 | a | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | b | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | c | 溶液由蓝色变为深绿色 |
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
现 象 |
| ① | d | 第一份NaBr溶液 | 溶液由蓝色变为蓝绿色 |
| ② | e | 第一份NaBr溶液 | 溶液由蓝色变为草绿色 |
| ③ | f | 第一份NaBr溶液 | 溶液由蓝色变为深绿色 |
| 编号 | 5mlCuSO4溶液 | 10mlNaBr溶液 (mol?L-1) |
温度 | 现象 |
| ① | 第一份CuSO4溶液 | 第一份NaBr溶液 | 25℃ | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | 第一份NaBr溶液 | 60℃ | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | 第一份NaBr溶液 | 75℃ | 溶液由蓝色变为深绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 编号 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 现象 |
| ① | 第一份CuSO4溶液 | a | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | b | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | c | 溶液由蓝色变为亮绿色 |
| 编号 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 现象 |
| ① | d | 第一份NaBr溶液 | 溶液由蓝色变为蓝绿色 |
| ② | e | 第一份NaBr溶液 | 溶液由蓝色变为草绿色 |
| ③ | f | 第一份NaBr溶液 | 溶液由蓝色变为亮绿色 |
| 编号 | 5mlCu2+溶液(mol?L-1) | 10ml Br-溶液(mol?L-1) | 温度 | 现象 |
| ① | 第一份CuSO4溶液 | 第一份NaBr溶液 | 25℃ | 溶液由蓝色变为蓝绿色 |
| ② | 第一份CuSO4溶液 | 第一份NaBr溶液 | 60℃ | 溶液由蓝色变为草绿色 |
| ③ | 第一份CuSO4溶液 | 第一份NaBr溶液 | 75℃ | 溶液由蓝色变为亮绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 红 红 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com