
下列4种装置工作一段时间后,测得导线上均通过了0.002mol 电子,此时溶液的pH值由大到小的排列顺序为(不考虑盐的水解和溶液体积变化)()
①盛100mL CuSO4 ②盛200mL 0.01mol•L﹣1 H2SO4 ③盛200mL ZnCl2 ④盛200mL NaCl饱和溶液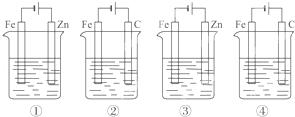
A. ④②③① B. ④③②① C. ④③①② D. ④①③②
考点: 电解原理.
专题: 电化学专题.
分析: 这四个装置都是电解池,①中阳极上锌失电子生成锌离子,阴极上铜离子得电子而析出铜,溶液由硫酸铜变为硫酸锌;
②中,阳极上氢氧根离子放电,阴极上氢离子放电,实质上是电解水;
③中实质上是电镀,溶液仍然为氯化锌溶液,溶液的pH不变;
④中阳极上氯离子放电,阴极上氢离子放电,所以溶液中氢氧根离子浓度增大.
解答: 解:①中电池反应式为:Zn+Cu2+=Cu+Zn2+,溶液由硫酸铜变为硫酸锌,溶液酸性减弱,pH增大;
②中,阳极上氢氧根离子放电,阴极上氢离子放电,实质上是电解水,溶液中硫酸浓度增大,所以氢离子浓度增大,pH最小;
③中实质上是电镀,溶液仍然为氯化锌溶液,溶液的pH不变;
④中阳极上氯离子放电,阴极上氢离子放电,所以溶液中氢氧根离子浓度增大,溶液呈碱性,pH增大,
则溶液pH从大到小的顺序是:④③①②,故选C.
点评: 本题考查了电解过程中溶液pH大小变化,根据溶液中氢离子或氢氧根离子浓度的变化结合盐类水解程度来分析解答,难度中等.


科目:高中化学 来源: 题型:
氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,在将滤液按下图所示步骤进行操作。
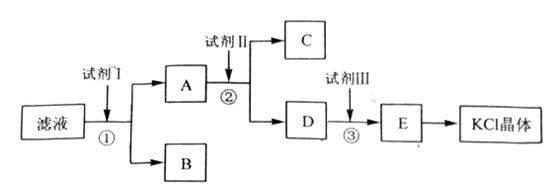
回答下列问题:
起始滤液的pH_____________7(填“大于”、“小于”或“等于”),其原因是_________________________________________________。
试剂I的化学式为______________________,①中发生反应的离子方程式为____________________________________________。
试剂Ⅱ的化学式为______________________,②中加入试剂Ⅱ的目的是__________________________________________________________________;
试剂Ⅲ的名称是______________________,③中发生反应的离子方程式为__________________________________________________________________;
某同学称取提纯的产品0.7759g,溶解后定定容在100mL容量瓶中,每次取25.00mL溶液,用0.1000mol·L-1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62mL,该产品的纯度为_______________________________________ _____。(列式并计算结果)
_____。(列式并计算结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
中华人民共和国国家标准(CB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图(a)装置(夹持装置略)收集某葡萄酒中的SO2,并对其含量进行测定。
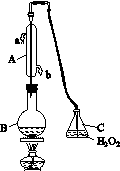
(a)
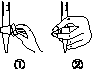
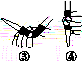
(b)
(1)仪器A的名称是__________________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中的H2O2完全反应,其化学方程式为________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图(b)中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________ g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
把下列现象中硫酸所表现出来的性质填写在空白处
(1)把锌粒放入稀硫酸中时,有气体放出。
(2)盛有浓硫酸的烧杯敞口放置一段时间后,质量增加。
(3)用玻璃棒蘸浓硫酸滴在纸上时,纸变黑。
(4)木炭放入热的浓硫酸中时,有气体放出。
(5)常温下可以用铁或铝的容器贮存浓硫酸
(6)热的浓硫酸与铜片等金属反应
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极分别电解下列各物质水溶液一段时间后,向剩余电解质溶液中加入适量水,能使溶液恢复到电解前浓度的是()
A. AgNO3 B. Na2SO4 C. CuCl2 D. H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
含Cr2O72﹣的工业酸性废水会造成铬污染,排放前要进行如下处理:(Ⅰ)往工业废水中加入适量的NaCl搅拌均匀;(Ⅱ)以Fe做两电极进行电解,从而使溶液的pH不断升高,废水由酸性转化为碱性,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生:(Ⅲ)过滤回收沉淀,废水达到排放标准.
(1)在电解过程中,溶液pH不断升高的原因可能是
①电解时废水的体积不断减小 ②电解时H+在阴极被还原 ③作为阳极的Fe不断溶解 ④Cr2O72﹣转化为Cr3+时消耗了H+ ⑤NaCl在电解时转化成了NaOH
A.⑤B.②④C.②③④D.①②③④
(2)两极发生反应的电极反应式为
阳极: ;阴极: .
(3)写出Cr2O72﹣变成Cr3+的离子方程式 .
(4) (填“能”或“不能”)改用石墨电极进行电解.
查看答案和解析>>
科目:高中化学 来源: 题型:
飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气中的SO2、O2接触时,SO2会部分转化为SO3,使空气的酸度增加,飘尘所起的作用可能是 ( )。
①氧化剂 ②还原剂 ③催化剂 ④吸附剂
A.①② B.① C.①③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
将amL NO、bmL NO2、xmL O2混合于同一试管中,将试管倒插入水中,待气体与水充分反应后,试管内的气体全部消失,则x对a、b的函数关系式x=f(a,b)为 ( )

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com