
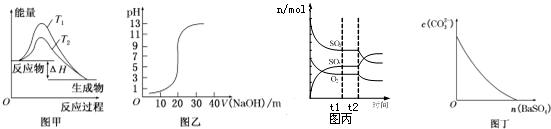
| A. | 图甲表示温度T1>T2,SO2与O2反应过程中的能量变化 | |
| B. | 图乙表示0.100 0 mol/L NaOH溶液滴定20.00ml 0.100 0 mol/L CH3COOH溶液所得到的滴定曲线 | |
| C. | 图丙表示一定条件下进行的反应2SO2+O2?2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 | |
| D. | 图丁表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)浓度变化 |
分析 A.图甲分析的是催化剂对反应活化能的影响,使用活化能改变反应历程,不改变反应的热效应;
B.0.100 0 mol/L CH3COOH溶液pH大于1;
C.缩小容器体积,相当于给体现加压,加压平衡向气体系数减小的方向移动;
D.饱和碳酸钠溶液中加入硫酸钡固体,实现沉淀的转化,碳酸钙离子浓度减小,但是建立的沉淀溶解和沉淀转化平衡状态,碳酸根离子不能减小为0.
解答 解:A.图象分析两个途径变化过程不同,反应物和生成物的能量相同,反应过程中能量变化相同,则比较的是同温下加入催化剂发生的变化,温度T1=T2,故A错误;
B.醋酸为弱酸,部分电离,所以0.100 0 mol/L CH3COOH溶液pH大于1,而图象乙起始时pH小于1,故B错误;
C.2SO2+O2?2SO3,为气体体积减小的反应,缩小容器体积,相当于给体现加压,加压平衡向气体系数减小的方向移动,二氧化硫、氧气的物质的量减小,三氧化硫的物质的量增大,故C正确;
D.饱和碳酸钠溶液中加入硫酸钡固体,实现沉淀的转化,碳酸钙离子浓度减小,但是建立的沉淀溶解和沉淀转化平衡状态,碳酸根离子不能减小为0,从图丁可知碳酸根离子减小为0,不符合客观事实,故D错误;
故选:C.
点评 本题为图象题,考查了催化剂对反应热影响图象,中和滴定pH变化图象,化学平衡图象,沉淀溶解平衡图象,准确把握图象含义,明确化学平衡移动原理是解题关键,注意催化剂参加反应,改变反应历程,但是不改变反应的热效应,题目难度中等.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 雾是气溶胶,在阳光下可观察到丁达尔效应 | |
| B. | 预制备Fe(OH)3胶体,向盛有沸水的烧杯中加入FeCl3饱和溶液煮沸得红褐色沉淀 | |
| C. | 用石膏或卤水点制豆腐利用了胶体的性质 | |
| D. | 用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. ,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是
,其晶体类型属于分子晶体,④与⑥形成的原子个数比为1:1的化合物的电子式是 ,其晶体类型属于离子晶体.
,其晶体类型属于离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
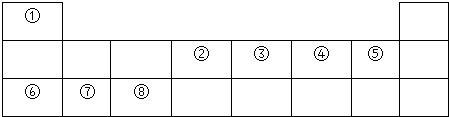
| 主族 周期 | IA | ⅡA | IIIA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
| 4 | ⑩ |
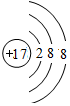 ,离子半径最大的是S 2-.
,离子半径最大的是S 2-.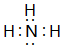 ;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为
;⑤的一种氧化物呈淡黄色,其含有的化学键类型有离子键和共价键,电子式为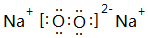 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该方应的正反应吸热 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
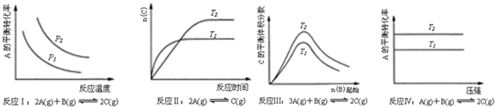
| A. | 反应Ⅰ:△H>0,P2>P1 | B. | 反应Ⅱ:△H<0,T1>T2 | ||
| C. | 反应Ⅲ:△H<0,T2>T1 | D. | 反应Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol水的体积是22.4L | |
| B. | 1molH2所占的体积一定是22.4L | |
| C. | 在标准状况下,NA个任何分子所占的体积约为22.4L | |
| D. | 在标准状况下,质量为28g的CO气体,其体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com