
【题目】在钢铁工业中,锰的用量仅次于铁.锰的冶炼所用原料为锰矿石,主要含菱锰矿![]() ,另常含有
,另常含有![]() 、FeO、
、FeO、![]() 、NaCl和石灰等.
、NaCl和石灰等.
金属阳离子 |
|
|
|
|
|
开始至沉淀 完全的pH |
|
|
|
|
|
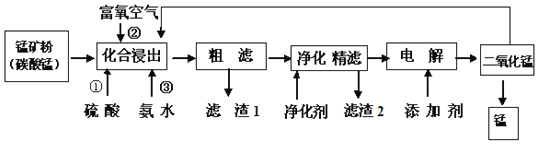
请回答下列问题:
![]() 在化合浸出中,为了提高浸出率提高产品纯度,通常采用______
在化合浸出中,为了提高浸出率提高产品纯度,通常采用______![]() 至少写两种方法
至少写两种方法![]()
![]() 在该工艺流程中滤渣1成分化学式为______;通常加入净化剂主要成分为
在该工艺流程中滤渣1成分化学式为______;通常加入净化剂主要成分为![]() ,滤渣2化学式为______.
,滤渣2化学式为______.
![]() 打捞韩国“岁月号”沉船是水下作业,潜水员需要呼吸的就是富氧空气.流程中用富氧空气作氧化剂,降低生产成本.流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是______
打捞韩国“岁月号”沉船是水下作业,潜水员需要呼吸的就是富氧空气.流程中用富氧空气作氧化剂,降低生产成本.流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是______
![]() 写出电解操作时阳极的电极反应式______.
写出电解操作时阳极的电极反应式______.
![]() 铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率,则离子反应方程式是:______.
铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率,则离子反应方程式是:______.
![]() 在电解液中
在电解液中![]() 不宜过大,否则在电解过程中会产生污染物,通常要定时检测
不宜过大,否则在电解过程中会产生污染物,通常要定时检测![]() 的大小,资料显示
的大小,资料显示![]() ,
,![]() ,且
,且![]() 为砖红色,通常采用
为砖红色,通常采用![]() 为滴定剂,用
为滴定剂,用![]() 作指示剂进行定量测定
作指示剂进行定量测定![]() 的大小.请描述该沉淀滴定终点时的现象:______;当
的大小.请描述该沉淀滴定终点时的现象:______;当![]() 沉淀完全时
沉淀完全时![]() 开始沉淀,此时溶液中
开始沉淀,此时溶液中![]() ______.
______.
【答案】升高温度、搅拌、减小颗粒粒径、适当延长浸泡时间 ![]() HgS 利用膜分离技术,氧分子可以通过,而氮分子不可以透过该膜
HgS 利用膜分离技术,氧分子可以通过,而氮分子不可以透过该膜 ![]()
![]() 当滴入最后一滴
当滴入最后一滴![]() 溶液时,有砖红色沉淀现象出现则达到终点;
溶液时,有砖红色沉淀现象出现则达到终点; ![]()
【解析】
锰的冶炼所用原料为锰矿石,主要含菱锰矿(MnCO3),另常含有Fe2O3、FeO、HgCO32HgO、NaCl和石灰等,化合浸出过程加入硫酸、固体溶解得到溶液,通入氧气氧化亚铁离子为铁离子,加入氨水沉淀铁离子生成氢氧化铁沉淀,粗滤得到滤渣为氢氧化铁,滤液加入净化剂主要成分为(NH4)2S,精滤得到滤渣2为HgS,滤液电解得到二氧化锰,利用铝热反应生成锰单质和氧化铝,铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率。
![]() 在化合浸出中,为了提高浸出率提高产品纯度,通常采用升高温度、搅拌、减小颗粒粒径、适当延长浸泡时间等,
在化合浸出中,为了提高浸出率提高产品纯度,通常采用升高温度、搅拌、减小颗粒粒径、适当延长浸泡时间等,
故答案为:升高温度、搅拌、减小颗粒粒径、适当延长浸泡时间;
![]() 分析可知滤渣1为氢氧化铁,化学式为:
分析可知滤渣1为氢氧化铁,化学式为:![]() ,滤渣2为硫化汞,化学式为:HgS,
,滤渣2为硫化汞,化学式为:HgS,
故答案为:![]() ;HgS;
;HgS;
![]() 流程中用的空气是用膜分离法制备的富氧空气,其原理为空气中的氧气和氮气透过分离膜的能力不同,
流程中用的空气是用膜分离法制备的富氧空气,其原理为空气中的氧气和氮气透过分离膜的能力不同,
故答案为:利用膜分离技术,氧分子可以通过,而氮分子不可以透过该膜;
![]() 电解操作时阳极是锰离子失电子发生氧化反应生成二氧化锰,反应的电极反应为:
电解操作时阳极是锰离子失电子发生氧化反应生成二氧化锰,反应的电极反应为:![]()
![]() ,
,
故答案为:![]() ;
;
![]() 铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率,是二氧化锰氧化亚铁离子,本身被还原为锰离子,反应的离子方程式为:
铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率,是二氧化锰氧化亚铁离子,本身被还原为锰离子,反应的离子方程式为:![]() ,
,
故答案为:![]() ;
;
![]() 为砖红色,通常采用
为砖红色,通常采用![]() 为滴定剂,用
为滴定剂,用![]() 作指示剂进行定量测定
作指示剂进行定量测定![]() 的大小,该沉淀滴定终点时的现象是当滴入最后一滴
的大小,该沉淀滴定终点时的现象是当滴入最后一滴![]() 溶液时,有砖红色沉淀现象出现则达到终点,当
溶液时,有砖红色沉淀现象出现则达到终点,当![]() 沉淀完全时浓度为
沉淀完全时浓度为![]() ,此时的离子浓度
,此时的离子浓度![]() ,
,![]() 开始沉淀,此时溶液中
开始沉淀,此时溶液中![]() ,
,
故答案为:当滴入最后一滴![]() 溶液时,有砖红色沉淀现象出现则达到终点;
溶液时,有砖红色沉淀现象出现则达到终点;![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知反应aA(g)+bB(g)![]() cC(g),某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。

(1)从反应开始到12s时,用A表示的反应速率为___。
(2)经测定,前4s内v(C)=0.05mol·L-1·s-1,则该反应的化学方程式为___。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经相同时间后,测量三个容器中的反应速率分别为甲:v(A)=0.3mol·L-1·s-1,乙:v(B)=0.12mol·L-1·s-1,丙:v(C)=9.6mol·L-1·min-1。则甲、乙、丙三个容器中反应速率由快到慢的顺序为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香柠檬酚具有抗氧化功能,它的结构如图,下列说法正确的是( )
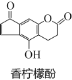
A.它的分子式为C13H9O4
B.它与H2发生加成反应,1mol最多可消耗7mol H2
C.它与溴水发生反应,1mol最多消耗3molBr2
D.它与NaOH溶液反应,1mol最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.在蒸馏水中滴加浓![]() ,
,![]() 不变
不变
B.含有AgCl和AgI固体的悬浊液:![]()
C.pH相同的![]() 三种溶液的
三种溶液的![]() :
:![]()
D.室温下,![]() 的盐酸与
的盐酸与![]() 的氨水等体积混合,所得溶液中:
的氨水等体积混合,所得溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几种有机物:
A.![]() B.
B.![]() C.
C.![]() D.CH2 = CH—CH = CH2E.环戊烷
D.CH2 = CH—CH = CH2E.环戊烷
(1)上述有机物中互为同系物的是_____________,互为同分异构体的是____________。
(2)用系统命名法对B进行命名____________________________________。
(3)A与Cl2反应的类型为_____________;D使溴水褪色的反应类型为___________。
(4)B发生加聚反应的化学方程式为 ____________________________________。
(5)如图表示的是一种叫做双烯合成的有机反应,请写出B与D发生双烯合成所得产物的结构简式__________________。
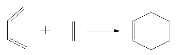
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请参照元素①—⑥的位置回答下列问题:
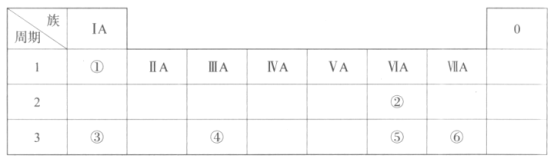
(1)元素①的一种核素中,含有1个质子和1个中子,表示该核素组成的符号是__。
(2)⑤的原子结构示意图是__。
(3)上述元素中,原子半径最大的是__(写元素符号)。
(4)仅由①、⑥组成的化合物的电子式为__,该化合物的分子中含有__(填“极性”或“非极性”)共价键。
(5)金属性:③__④(填“>”或“<”),列举一条能证明该结论的实验事实:__。
(6)下列说法正确的是__(填序号)。
a.②、③组成的化合物只有一种
b.②的气态氢化物稳定性高于⑤
c.⑥在化合物中呈现的最高化合价为+7价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 1.0molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热。试回答下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是___________。

(2)大烧杯上如不盖硬纸板,对求得中和热数值的影响是_____(填“偏高”“偏低”或“无影响”)。
(3)如果改用60 mL 1.0 molL﹣1盐酸跟50 mL 1.1 molL﹣1氢氧化钠溶液进行反应,则与上述实验相比,所放热量_____(填“增加”“减少”或“不变”);所求中和热数值_____(填“增加”“减少”或“不变”)。
(4)_____(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液。
(5)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值。该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2﹣t1)/℃ |
1 | 25.0 | 32.6 | |
2 | 25.1 | 31.8 | |
3 | 25.1 | 31.9 |
已知盐酸、NaOH溶液密度近似为1.00 gcm﹣3,中和后混合液的比热容c=4.184×10﹣3kJg﹣1℃﹣1则该反应的中和热为△H=_____(保留小数点后一位)。
(6)上述实验数值结果与57.3 kJmol﹣1有偏差,产生偏差的原因可能是_____(填字母)。
a.实验装置保温、隔热效果差 b.量取盐酸的体积时仰视读数
c.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向![]() 溶液中加入
溶液中加入![]() 溶液,可观察到的现象是______,发生反应的离子方程式为______,若将所得悬浊液的pH值调整为4,则溶液中
溶液,可观察到的现象是______,发生反应的离子方程式为______,若将所得悬浊液的pH值调整为4,则溶液中![]() 的溶液为______
的溶液为______![]()
![]() 已知常温下
已知常温下![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.0.01 mol·L-1氯水中,Cl2、Cl-和ClO-三粒子数目之和大于0.01NA
B.在标准状况下,11.2 L NO与11.2 L O2混合后所含分子数为0.75NA
C.0.1 mol Cu与含0.2mol H2SO4的浓硫酸完全反应后,溶液中Cu2+数目为0.1NA
D.2.0 g D2O中含有的质子数、电子数均为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com