
| A. | 磷原子的质子数为14 | B. | 氧元素在第二周期 | ||
| C. | 氯元素的最高化合价为+7 | D. | 还原性 Na<K |
 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:解答题
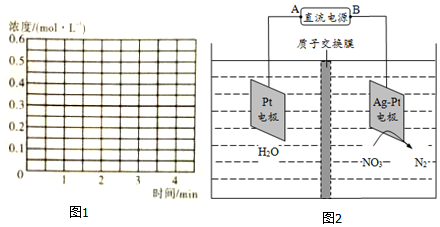
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔球棍模型: | B. | 质量数为的37的原子${\;}_{37}^{17}$Cl | ||
| C. | 氯化镁电子式: | D. | 氯离子的结构示意图: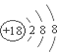 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钾溶于水时离子键未被破坏 | B. | 分子间作用力越大,分子越稳定 | ||
| C. | 冰融化时分子中共价键发生断裂 | D. | 原子晶体中共价键越强,熔点越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
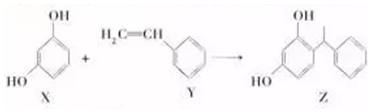
| A. | lmolX与溴水反应消耗3molBr2 | |
| B. | X能与Na2CO3溶液反应 | |
| C. | Y既能发生取代反应,也能发生加成反应 | |
| D. | 用酸性KMnO4溶液可鉴别X、Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com