
| A. | CH3COONa | B. | CH3COOH和CH3COONa | ||
| C. | CH3COONa和NaOH | D. | CH3COOH和NaOH |
分析 A.醋酸钠溶液中存在水的电离和醋酸钠的电离;
B.醋酸存在电离平衡,醋酸钠完全电离,溶液中存在水的电离;
C.醋酸钠、氢氧化钠完全电离,溶液中存在水的电离;
D.醋酸和氢氧化钠是酸和碱混合发生中和反应;
解答 解:A.醋酸钠溶液中存在水的电离和醋酸钠的电离,溶液中存在Na+、CH3COO-、H+、OH-,故A不符合;
B.醋酸存在电离平衡,醋酸钠完全电离,溶液中存在水的电离,溶液中存在Na+、CH3COO-、H+、OH-,故B不符合;
C.醋酸钠、氢氧化钠完全电离,溶液中存在水的电离,溶液中存在Na+、CH3COO-、H+、OH-,故C不符合;
D.醋酸和氢氧化钠是酸和碱混合发生中和反应,溶液中不能同时存在CH3COOH和NaOH两种溶质,故D符合;
故选D.
点评 本题考查了盐类水解、电解质电离,主要是溶液中离子存在的种类判断,酸碱不能在溶液中共同存在做溶质,题目较简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
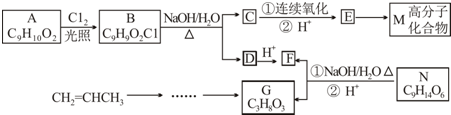
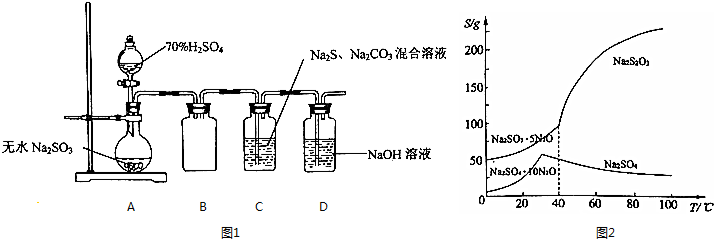
 .
. .
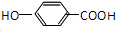
.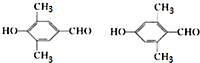 .
.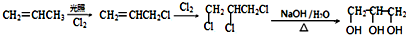 . (已知:CH2=CHCH3$→_{Cl_{2}}^{光照}$CH2=CHCH2Cl)
. (已知:CH2=CHCH3$→_{Cl_{2}}^{光照}$CH2=CHCH2Cl)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验某补铁药片(主要成分为亚铁化合物)是否氧化变质,使用氯水和硫氰化钾溶液 | |
| B. | 测定溶液pH时,可用pH试纸蘸取少量待测液,并与标准比色卡比较 | |
| C. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度,使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| D. | 测定碳酸钠中碳酸氢钠的含量:取a克样品与足量稀盐酸充分反应,逸出的气体通过碱石灰后,碱石灰增重b克,根据a和b的值即可求得碳酸氢钠的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
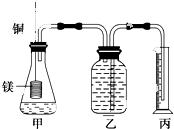 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数编号 | 盐酸溶液体积V(mL) | 氢氧化钠溶液体积V(mL) |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| NaOH的质量分数 | 阳极析出物质的质量/g | 阴极析出物质的质量/g | |
| A | 6.2% | 19 | 152 |
| B | 6.2% | 152 | 19 |
| C | 4.2% | 1.2 | 9.4 |
| D | 4.2% | 9.4 | 1.2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com