
| 反应时间/min | n(CO)/mol | n(H2)/mol |
| 0 | 0.60 | 1.20 |
| 20 | 0.20 | |
| 30 | 0.40 |
| A. | 反应在20 min内的平均速率为v(H2)=0.04 mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(CH3OH)=0.15 mol•L-1,则反应的△H<0 | |
| C. | 保持其他条件不变,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,达到新平衡前v(正)>v(逆) | |
| D. | 相同温度下,若起始时向容器中充入1.0 mol CH3OH,达到平衡时CH3OH转化率大于$\frac{1}{3}$ |
分析 由反应可知,30min时转化的氢气为0.8mol,则转化的CO为0.4mol,则剩余的CO为0.6mol-0.4mol=0.2mol,可知20min时达到平衡,则
CO(g)+2H2(g)?CH3OH(g)
开始 0.6 1.2 0
转化 0.4 0.8 0.4
平衡 0.2 0.4 0.4
A.结合v=$\frac{△c}{△t}$计算;
B.平衡时c(CH3OH)=0.2mol/L,升高温度,平衡时c(CH3OH)=0.15 mol•L-1,可知升高温度平衡逆向移动;
C.K=$\frac{0.2}{0.1×(0.2)^{2}}$=50,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,Qc=$\frac{0.3}{0.2×(0.3)^{2}}$=16.67<K,平衡正向移动;
D.若起始时向容器中充入1.0 mol CH3OH,设转化的甲醇为x,K=$\frac{1}{50}$=0.02,
CH3OH(g)?CO(g)+2H2(g)
开始 1.0 0 0
转化 x x 2x
平衡 1-x x 2x
$\frac{x×(2x)^{2}}{1-x}$=0.02,如x=$\frac{1}{3}$时,$\frac{x×(2x)^{2}}{1-x}$>0.02,则x<$\frac{1}{3}$时满足题意.
解答 解:由反应可知,30min时转化的氢气为0.8mol,则转化的CO为0.4mol,则剩余的CO为0.6mol-0.4mol=0.2mol,可知20min时达到平衡,则
CO(g)+2H2(g)?CH3OH(g)
开始 0.6 1.2 0
转化 0.4 0.8 0.4
平衡 0.2 0.4 0.4
A.反应在20 min内的平均速率为v(H2)=$\frac{\frac{0.8mol}{2L}}{20min}$=0.02mol•L-1•min-1,故A错误;
B.平衡时c(CH3OH)=0.2mol/L,升高温度,平衡时c(CH3OH)=0.15 mol•L-1,可知升高温度平衡逆向移动,则反应的△H<0,故B正确;
C.K=$\frac{0.2}{0.1×(0.2)^{2}}$=50,再向平衡体系中同时通入0.20 mol CO、0.20 mol H2、0.20 mol CH3OH,Qc=$\frac{0.3}{0.2×(0.3)^{2}}$=16.67<K,平衡正向移动,则达到新平衡前v(正)>v(逆),故C正确;
D.若起始时向容器中充入1.0 mol CH3OH,设转化的甲醇为x,K=$\frac{1}{50}$=0.02,
CH3OH(g)?CO(g)+2H2(g)
开始 1.0 0 0
转化 x x 2x
平衡 1-x x 2x
$\frac{x×(2x)^{2}}{1-x}$=0.02,如x=$\frac{1}{3}$时,$\frac{x×(2x)^{2}}{1-x}$>0.02,则x<$\frac{1}{3}$时满足题意,则达到平衡时CH3OH转化率小于$\frac{1}{3}$,故D错误;
故选BC.
点评 本题考查化学平衡的计算,为高频考点,把握表格中的数据、平衡三段法、K及速率的计算为解答的关键,侧重分析与计算能力的考查,注意选项D为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ①③④⑥ | C. | ②③④⑥ | D. | ⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成的沉淀纯度更高 | |
| B. | 形成较多的白色沉淀 | |
| C. | 排除CO32-、SO32- 和Ag+等离子的干扰 | |
| D. | 盐酸加与不加对实验结果不影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2有毒,可以用作某些食品防腐剂 | |
| B. | 铅笔芯的原材料为铅,儿童使用时如果用嘴吮吸能够引起铅中毒 | |
| C. | 双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害 | |
| D. | 科学家推测月尘[即月球上直径小于10μm(1μm=1×10-6m)的浮尘]是“玉兔号”出现控制异常情况的主要原因,月尘分散在空气中形成的分散系属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
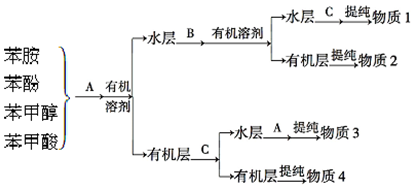
 )具有碱性.
)具有碱性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 结论 |
| A | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH,前者pH比后者的大 | 非金属性:S>C |
| B | 向苯酚浊液中滴加Na2CO3溶液,浊液变澄清 | CO32-结合质子能力比C6H5O-弱 |
| C | 向10mL 0.2mol•L-1NaOH溶液中滴入2滴0.1mol•L-1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol•L-1FeCl3溶液,白色沉淀转化为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡、静置,下层溶液显紫红色 | Fe3+的氧化性大于I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com