
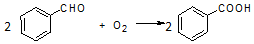
| 名称 | 分子量 | 性状 | 相对密度 (g•cm-3) | 沸点 (℃) | 溶解度 | ||
| 水 | 乙醚 | ||||||
| 苯甲醛 | 106 | 无色液体 | 1.04 | 179 | 微溶 | 易溶 | |
| 苯甲酸 | 122 | 无色晶体 | 1.27 | 249 | 0.21g | 66g | |
| 苯甲醇 | 108 | 无色液体 | 1.04 | 205 | 微溶 | 易溶 | |
| 乙醚 | 74 | 无色液体. | 0.71 | 35 | 不溶 | -- | |
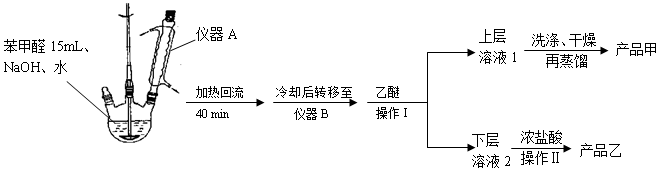
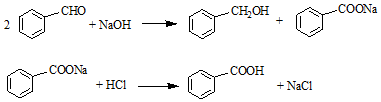
分析 由流程结合题中信息可知,苯甲醛与NaOH反应生成白色糊状物为苯甲醇、苯甲酸钠的混合物,然后加水、乙醚萃取苯甲醇,则乙醚溶液中含苯甲醇,操作I为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钠,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作为过滤,则产品乙为苯甲酸,以此来解答.
(1)由仪器结构特征,可知A为冷凝管,可以使物质冷凝回流;
(2)苯甲醛和氢氧化钠反应得到苯甲酸钠和苯甲醇,二者互溶,分离采用蒸馏法,苯甲酸钠可以和盐酸之间反应得到苯甲酸和氯化钠,获得苯甲酸可以进行抽滤;
(3)①有机物苯甲酸、苯甲醛的沸点较低,易溶于有机物溶剂中;
②为便于分离物质,洗涤操作在分液漏斗正确进行;
③加入10%的Na2CO3溶液除去生成的苯甲酸;
(4)根据苯甲醛计算苯甲醇的理论产量,产率=$\frac{实际产量}{理论产量}$×100%.
解答 解:由流程结合题中信息可知,苯甲醛与NaOH反应生成白色糊状物为苯甲醇、苯甲酸钠的混合物,然后加水、乙醚萃取苯甲醇,则乙醚溶液中含苯甲醇,操作I为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钠,加盐酸发生强酸制取弱酸的反应,生成苯甲酸,苯甲酸的溶解度小,则操作为过滤,则产品乙为苯甲酸,
(1)由仪器结构特征,可知A为冷凝管,作用是冷凝回流,故答案为:冷凝回流;
(2)苯甲醛和氢氧化钠反应得到苯甲酸钠和苯甲醇,二者互溶,分离采用蒸馏法,苯甲醇的沸点是205℃,所以蒸馏操作时温度应该控制在205℃左右,苯甲酸钠可以和盐酸之间反应得到苯甲酸,获得产品乙苯甲酸时进行的操作Ⅱ的名称是 抽滤(过滤、减压过滤).
故答案为:205℃;抽滤(过滤、减压过滤);
(3)①上层液中还含有未反应的苯甲醛、苯甲酸,苯甲酸、苯甲醛的沸点较低,易溶于有机物溶剂中,即上层溶液1中除乙醚外主要有机杂质是苯甲醛、苯甲酸,故答案为:苯甲醛、苯甲酸;
②苯甲醛、苯甲酸易溶解在有机溶剂中,洗涤操作在分液漏斗正确进行;
故答案为:d;
③加入10%的Na2CO3溶液除去生成的苯甲酸,加入10%的Na2CO3溶液除去生成的苯甲酸,没有气泡生成时说明杂质已被除尽,
故答案为:无气泡生成;
(4)15.0mL苯甲醛的质量为15.0mL×1.06g/mL,其物质的量为$\frac{15×1.04}{106}$mol≈0.15mol,由方程式可知生成苯甲醇为$\frac{0.15mol}{2}$=0.075mol,故苯甲醇的产率为$\frac{5.4}{0.075×108}$×100%=66.7%,
故答案为:66.7%.
点评 本题考查有机物制备实验,侧重考查学生对原理及操作的分析评价、物质的分离提纯、仪器的识别与用途等,关键是充分利用题目给予的信息进行解答,较好的考查学生分析推理能力、知识迁移运用能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
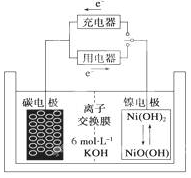 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )
一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如图所示,该电池的电解质为6mol•L-1KOH溶液,下列说法中正确的是( )| A. | 放电时K+移向负极 | |
| B. | 放电时电池负极的电极反应为H2-2e-═2H+ | |
| C. | 放电时电池正极的电极反应为NiO(OH)+H2O+e-═Ni(OH)2+OH- | |
| D. | 该电池充电时将碳电极与电源的正极相连,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
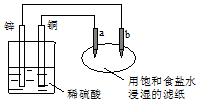
| A. | 往滤纸上滴加酚酞试液,a极附近颜色变红 | |
| B. | 锌电极上的反应:Zn-2e→Zn2+ | |
| C. | 稀硫酸中硫酸根离子的物质的量不变 | |
| D. | a是阳极,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2,下列说法不正确的是( )
近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2,下列说法不正确的是( )| A. | 太阳能最终转变为化学能 | B. | CeO2是水分解的催化剂 | ||
| C. | T<1050℃时,CeO2-δ比CeO2稳定 | D. | 两步反应均属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气均为化石燃料,它们属于可再生资源 | |
| B. | 大自然利用太阳能最成功的是植物的光合作用 | |
| C. | 石油的分馏、催化裂化、裂解等石油加工方法,其目的均为得到更多的汽油 | |
| D. | 化肥的大量使用不会造成环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.

 扑热息痛的结构简式为
扑热息痛的结构简式为


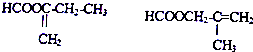
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
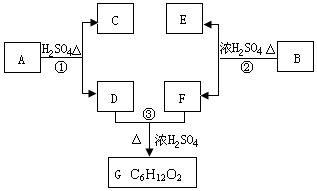 A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示:
A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示: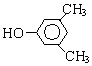 或
或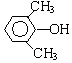 或
或 (写出一种即可).
(写出一种即可). 或
或
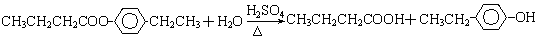 .①反应的反应类型取代反应
.①反应的反应类型取代反应 或
或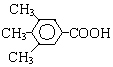 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和H2 | B. | C6H12O6 | C. | CH2O2 | D. | C2H5OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com