
| A. | 加入烧碱溶液主要是除去Mg2+、Fe3+ | |
| B. | 药品加入的先后顺序可以是②③④① | |
| C. | 加入稀盐酸主要是除去所加过量物质中的OH-、CO32- | |
| D. | 加入碳酸钠溶液主要是除去Ca2+及所加过量物质中的Ba2+ |
分析 饱和食盐水含Ca2+、Mg2+、SO42-、Fe3+等杂质离子,应先加入过量BaCl2,除去SO42-,然后加过量Na2CO3,可除去Ca2+、Mg2+、Fe3+等,过滤后加入盐酸可除去Na2CO3,除钡离子要放在除碳酸根离子前,据此回答.
解答 解:饱和食盐水含Ca2+、Mg2+、SO42-、Fe3+等杂质离子,应先加入过量BaCl2,除去SO42-,然后加过量Na2CO3,可除去Ca2+、Mg2+、Fe3+等,过滤后加入盐酸可除去Na2CO3.
A、加入烧碱溶液主要是除去Mg2+、Fe3+,故A正确;
B、药品加入的先后顺序可以是②④③①,除钡离子要放在除碳酸根离子前,故B错误;
C、加入稀盐酸主要是除去所加过量物质中的OH-、CO32-,放在最后,故C正确;
D、加入碳酸钠溶液主要是除去Ca2+及所加过量物质中的Ba2+,故D正确.
故选B.
点评 本题考查了原电池和电解池原理的综合应用,涉及饱和食盐水的精制、电解方程式、电极方程式等知识,要求学生具有分析和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯净的液氨中,pN=7 | |
| B. | 纯净的液氨中,c(NH4+)•c(NH2-)>1.0×10-14 | |
| C. | 1 L溶解有0.001 mol NH4C1的液氨溶液,其pN=3 | |
| D. | 1 L溶解有0.001 mol NaNH2的液氨溶液,其pN=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Fe3+ | B. | HCO3-、Al3+ | C. | Ba2+、SO42- | D. | Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烯 乙二醇: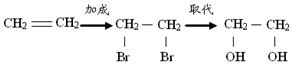 | |
| B. | 溴乙烷 乙醇:CH3CH2Br$\stackrel{水解}{→}$CH2═CH2$\stackrel{加成}{→}$CH3CH2OH | |
| C. | 1-溴丁烷 1,3-丁二烯: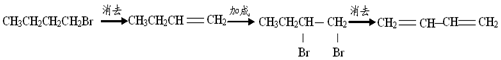 | |
| D. | 乙烯 乙炔: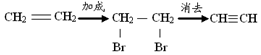 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>Fe3+>I2>S | B. | Cl2>I2>Fe3+>S | C. | Cl2>Fe3+>S>I2 | D. | Fe3+>I2>C12>S |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Ba2+)浓度增大 | B. | 溶液中Ba2+数目减少 | ||
| C. | 溶液pH减小 | D. | 溶液pH增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com