
(8分)将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:
(以下均假设反应过程中溶液体积不变)。
⑴铁片上的电极反应式为 。
⑵铜片周围溶液会出现 的现象。
⑶若2 min后测得铁片和铜片之间的质量差为1.2g,计算:
①导线中流过的电子的物质的量为 mo1;
②该段时间内用硫酸铜表示的平均反应速率为
(1)Fe-2e-=Fe 2+;(2)溶液颜色变浅;(3)①0.02;② 0.01mol?L-1?min-1。
解析试题分析:(1)铁片、铜片和硫酸铜溶液构成原电池,铁较活泼,作原电池的负极,电极反应式为Fe-2e-=Fe 2+;(2)铜电极作原电池的正极,电极反应式为Cu2++2e-=Cu,铜离子浓度降低,则溶液颜色变浅;(3)①负极上铁溶解,正极上析出铜,铁片和铜片相差的质量为溶解铁和析出铜的质量之和,溶解铁的物质的量和析出铜的物质的量相等,设转移电子的物质的量为xmol,x/2×56+x/2×64=1.2,x=0.02;②硫酸铜的平均反应速率=0.01mol/(2min×0.5L)=0.01mol?L-1?min-1。
考点:考查原电池原理。


科目:高中化学 来源: 题型:单选题
两种金属A与B和稀硫酸组成原电池时,A是正极。下列有关推断正确的是
| A.A的金属性强于B | B.电子不断由A电极经外电路流向B电极 |
| C.A电极上发生的电极反应是还原反应 | D.A的金属活动性一定排在氢前面 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)现有如下两个反应:
A.NaOH + HCl =" NaCl" + H2O B.2FeCl3+Cu =2FeCl2+CuCl2
(1)根据两反应本质, 判断能设计成原电池的是:_______,(填序号 )。
(2)不能的, 说明其原因_______________________________________________;(2分)
(3)如果可以, 写出负极材料及其电极反应式, 电解质溶液名称:
负极材料________,电极反应式_______________,电解质溶液名称____________,
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)试用 ══
══ ↑的反应设计原电池。
↑的反应设计原电池。
(1)原电池中使用的电解质溶液是 ;
(2)写出电极反应式:
负极: ,
正极: ;
(3)在方框中画出此原电池的图,并标出电极材料的名称。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为以惰性电极进行电解的串联电解装置图
(1)写出A、B、C、D各电极上的电极方程式。
A ;
B ;
C ’
D 。
(2)在A、B、C、D各电极上析出生成物的物质的量比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.下图为氢氧燃料电池的结构示意图,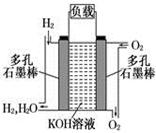
电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1) 写出氢氧燃料电池工作时正极电极反应方程式: ___________ 。
(2)如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下___________L氧气。
(3) 若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________________。 电池总离子反应方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第 周期.第 族;PbO2的酸性比CO2的酸性 (填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 ;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为 ,阴极上观察到的现象是 ;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为 ,这样做的主要缺点是 。
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重的4.0%(即样品起始质量—a点固体质量/样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2 ·nPbO,列式计算x值和m:n值 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
锂的化合物用途广泛。Li3N是非常有前途的储氢材料;LiFePO4、Li2FeSiO4等可以作为电池的正级材料。回答下列问题:
(1)将锂在纯氮气中燃烧可制得Li3N,其反应的化学方程为 。
(2)氮化锂在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为:
Li3N+2H2 LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
(3)将Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃的氩气中烧结6小时制得Li2FeSiO4,写出反应的化学方程式 ,制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是 。
(4)将一定浓度磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出LiFePO4沉淀,阳极的电极反应式为 。
(5)磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe—
FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe— XLi++6C,写出电池放电时的电极反应的化学方程式 。
XLi++6C,写出电池放电时的电极反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 。
(2)铝与氢氧化钾溶液反应的离子方程式是 。
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。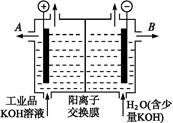
①该电解槽的阳极反应式是 。
②通电开始后,阴极附近溶液pH会增大,请简述原因 。
③除去杂质后的氢氧化钾溶液从溶液出口 (填写“A”或“B”)导出。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com