
分析 X、Y和Z为三种不同周期的短周期元素,其原子序数依次增大,且知:X与Y可形成原子个数比分别为1:1的共价化合物甲和2:1的共价化合物乙;Y与Z可形成原子个数比分别为1:1的离子化合物丙和2:1的离子化合物丁,可推知X为H、Y为O、Z为Na,甲为H2O2,乙为H2O,丙为Na2O2,丁为Na2O.
解答 解:X、Y和Z为三种不同周期的短周期元素,其原子序数依次增大,且知:X与Y可形成原子个数比分别为1:1的共价化合物甲和2:1的共价化合物乙;Y与Z可形成原子个数比分别为1:1的离子化合物丙和2:1的离子化合物丁,可推知X为H、Y为O、Z为Na,甲为H2O2,乙为H2O,丙为Na2O2,丁为Na2O.
(1)Y为O元素,处于周期表中第二周期ⅥA族,故答案为:二、ⅥA;
(2)化合物甲为H2O2,故答案为:H2O2,;
(3)化合物丙为Na2O2,含有离子键、共价键,故答案为:离子键、共价键;
(4)O2-、Na+离子电子层结构相同,核电荷数越大离子半径越小,故r(O2-)>r(Na+),故答案为:>.
点评 本题结构性质位置关系综合应用,关键是根据物质组成特点进行推断,需要学生熟练掌握元素化合物知识,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 2C6H6+15O2$\stackrel{点燃}{→}$12CO2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2是还原产物,CO2是氧化产物 | |
| B. | 每生成22.4LCO2需转移3 mol电子 | |
| C. | 反应中氧化剂和还原剂的物质的量之比为4:3 | |
| D. | N元素既被氧化,也被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则PM为2.5的大气一定能产生丁达尔现象 | |
| B. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| C. | ${\;}_{1}^{2}$H、${\;}_{1}^{3}$H是制造氢弹的原料,它们是同一种核素 | |
| D. | 太阳能电池可采用硅材料制作,其应用有利于环保、节能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3,4-二甲基-4-己基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 3,4,4-三甲基己烷 | D. | 2,3,3-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10L | B. | 15L | C. | 25L | D. | 27L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
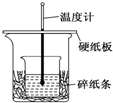 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )| A. | 如图条件下实验过程中没有热量损失 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是固定小烧杯 | |
| D. | 若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,理论上所求反应热偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| B. | 等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| C. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+$\frac{\underline{\;\;△\;\;}}{\;}$Fe3++3NO2↑+3H2O | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:NH4++Al3++2 SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com