
【题目】下列有关实验原理的说法中正确的是![]()
![]()
①探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏低
②在试管中加入3~5mL稀盐酸,再用胶头滴管逐滴加入![]() 溶液,即可制得硅酸胶体
溶液,即可制得硅酸胶体
③在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度,充分反应后再读出并记录反应体系的最高温度
④用标准酸液、甲基橙试液、pH计、滴定管![]() 酸式和碱式
酸式和碱式![]() 、锥形瓶、蒸馏水等主要仪器和药品即可完成某一未知浓度氨水电离程度的测定实验
、锥形瓶、蒸馏水等主要仪器和药品即可完成某一未知浓度氨水电离程度的测定实验
A.①②B.③④C.①④D.②③
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验能实现的是( )
A. 图1装置左侧用于检验氯化铵受热分解出的氨气
图1装置左侧用于检验氯化铵受热分解出的氨气
B. 图2装置用于分离碘单质和高锰酸钾固体混合物
图2装置用于分离碘单质和高锰酸钾固体混合物
C.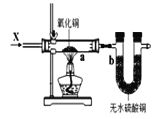 图3装置中若a处有红色物质生成,b处变蓝,证明X一定是H2
图3装置中若a处有红色物质生成,b处变蓝,证明X一定是H2
D.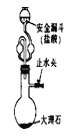 图4装置可以制取少量CO2,安全漏斗可以防止气体逸出
图4装置可以制取少量CO2,安全漏斗可以防止气体逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A. 上述反应在较高温度下才能自发进行
B. 该反应的正反应活化能小于逆反应活化能
C. 该反应中,断裂化学键的总键能大于形成化学键的总键能
D. 若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,![]() ,下列说法正确的是
,下列说法正确的是
A.用![]() 的盐酸滴定
的盐酸滴定![]() 的氨水时,可用酚酞作指示剂
的氨水时,可用酚酞作指示剂
B.![]() 的醋酸与
的醋酸与![]() 的氢氧化钠溶液等体积混合,所得溶液中:
的氢氧化钠溶液等体积混合,所得溶液中:![]()
C.![]() 的盐酸与
的盐酸与![]() 的氨水等体积混合,所得溶液中:
的氨水等体积混合,所得溶液中:![]()
D.![]() 的醋酸与
的醋酸与![]() 的氨水等体积混合,所得溶液中由水电离出的
的氨水等体积混合,所得溶液中由水电离出的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 阿司匹林(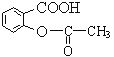 )能解热镇痛。
)能解热镇痛。
(1)阿司匹林属于__________(填“无机化合物”或“有机化合物”)。
(2)阿司匹林中含氧官能团有酯基和__________(填名称)。
(3)向阿司匹林的水溶液中滴入2~3滴紫色石蕊溶液,溶液颜色变红,说明阿司匹林溶液具有________性。
(4)阿司匹林在一定条件下水解生成水杨酸(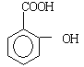 )和另一种酸A ,试写出另一种酸A的结构简式__________。
)和另一种酸A ,试写出另一种酸A的结构简式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界水体中的碳元素主要以碳酸盐、碳酸氢盐和有机物形式存在。水体中有机物含量是水质的重要指标,常用总有机碳来衡量(总有机碳=水样中有机物所含碳元素的质量/水样的体积)。某学生兴趣小组用如下实验方法测定采集水样的总有机碳。
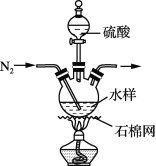
步骤1:量取50 mL水样,加入足量硫酸,加热,通N2,并维持一段时间(装置见上图,夹持类仪器省略)。
步骤2:再向水样中加入过量的K2Cr2O7溶液(可将有机物中的碳元素氧化成CO2),加热充分反应,生成的CO2完全被100 mL 0.205 mol·L-1的Ba(OH)2溶液吸收。
步骤3:将吸收CO2后的浊液过滤并洗涤沉淀,再将洗涤得到的滤液与原滤液合并,加水配制成500 mL溶液。量取25.00 mL溶液于锥形瓶中,加入指示剂,并滴加0.050 00 mol·L-1的H2C2O4溶液,发生反应:Ba(OH)2+H2C2O4=BaC2O4↓+2H2O。恰好完全反应时,共消耗H2C2O4溶液20.00 mL。
(1)步骤1的目的是__________________________________。
(2)计算水样的总有机碳(以mg·L-1表示),并写出计算过程。_______________
(3)用上述实验方法测定的水样总有机碳一般低于实际值,其原因可能是(写出一条即可)____
(4)高温燃烧可将水样中的碳酸盐、碳酸氢盐和有机物所含碳元素转化为CO2,结合高温燃烧的方法,改进上述实验。
①请补充完整改进后的实验方案:取V L的水样,分为两等份;将其中一份水样高温燃烧,测定生成CO2的物质的量为n1 mol;__________,测定生成CO2的物质的量为n2 mol。
②利用实验数据计算,所取水样的总有机碳为_____________mg·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.①常温常压,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。写出热化学方程式:________________________________________________________
②4g氢气燃烧生成水蒸气放出484kJ热量,热化学方程式是_______________

Ⅱ.如图表示在密闭容器中反应:2SO2+O2![]() 2SO3, △H < 0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是__________;b c过程中改变的条件可能是____________; 若减小压强时,反应速度变化情况画在c~d处_______。
2SO3, △H < 0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是__________;b c过程中改变的条件可能是____________; 若减小压强时,反应速度变化情况画在c~d处_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+3B![]() C+4D反应中,表示该反应速率最快的是( )
C+4D反应中,表示该反应速率最快的是( )
A.υ(A)=0.5mol/(L·s)B.υ(B)=0.8mol/(L·s)
C.υ(C)=0.3mol/(L·s)D.υ(D)=10mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com