
【题目】X、Y、Z、M是短周期的四种元素,原子序数依次增大。X和M为同一主族元素,Y的最外层电子数为3,Z是地壳中含量最高的元素,X、Y和M三元素可组成MYX4化合物,其结构式如图所示,下列说法错.误.的是( )
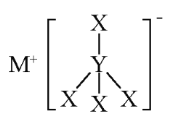
A.MYX4化合物中X的化合价为+1
B.Z与X、M形成的二元化合物均不止一种
C.M在自然界中以化合物形式存在
D.原子半径由大到小顺序为M>Y>Z>X
【答案】A
【解析】
Z是地壳中含量最高的元素,则Z为O元素,Y的最外层电子数为3,应为第ⅢA族元素,其原子序数小于O,所以应为B元素;根据化合物中各元素的成键特点可知,X和M应为第IA族元素,且X可以形成共价键,应为H元素,M的原子序数大于O,则M为Na元素。
A.MYX4为NaBH4,Na为+1价,B位于金属与非金属的交界处,金属性明显一些,电负性小于H,所以B显+3价,H为-1价,故A错误;
B.O和H可以形成H2O、H2O2,O和Na可以形成Na2O、Na2O2,故B正确;
C.Na化学性质活泼,在自然界中以化合物的形式存在,故C正确;
D.电子层数越多原子半径越大,电子层数相同核电荷数越小半径越大,所以原子半径Na>B>O>H,即M>Y>Z>X,故D正确;
故答案为A。


科目:高中化学 来源: 题型:
【题目】氨气和氯气是重要的工业原料,某兴趣小组设计了相关实验探究它们的某些性质。
实验一:认识喷泉实验的原理,并测定电离平衡常数K(NH3·H2O)。
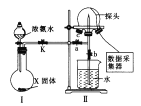
(1)使图中装置Ⅱ产生喷泉的实验操作是_____________________________________。
(2)喷泉实验结束后,发现三颈烧瓶中未充满水(假如装置的气密性良好),原因是______。用___________(填仪器名称)量取25.00 mL喷泉实验后的氨水至锥形瓶中,用0.0500 mol·L-1的盐酸测定氨水的浓度,滴定曲线如图所示。下列关于该滴定实验的说法中正确的是__________(填字母)。
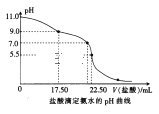
A.应选择甲基橙作为指示剂
B.当pH=7.0时,氨水与盐酸恰好中和
C.酸式滴定管未用盐酸润洗会导致测定结果偏低
D.当pH=11.0时,K(NH3·H2O)约为2.2×10-5
实验二:拟用如下装置设计实验来探究纯净、干燥的氯气与氨气的反应。
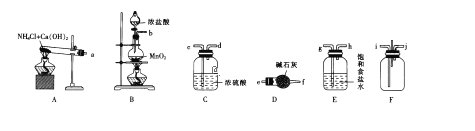
(3)A中所发生反应的化学方程式为__________________________________。
(4)上图中的装置连接顺序为①_________②_________③_________(用大写字母表示)。若按照正确顺序连接实验装置后,则整套实验装置存在的主要缺点是________。
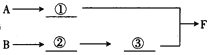
(5)写出F装置中的反应的一种工业用途:___________________________________。
(6)反应完成后,F装置中底部有固体物质生成。请利用该固体物质设计一个实验方案证明NH3·H2O为弱碱(其余实验用品自选):___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)是人体必需的微量元素,能预防突发性心脏病等疾病,其常见化合价有+2、+3、+4、+5,实验室模拟工业生产制备V2(CO3)3的步骤如下:
I.取18.20gV2O5放入水中搅拌形成悬浊液,在酸性条件下,通入二氯化硫充分反应可得V2(SO4)3溶液;
II.将V2(SO4)3溶液与足量的碳酸钠溶液混合,充分反应后过滤,洗涤、干燥,得V2(CO3)3固体22.56g。
已知:+5价V具有氧化性,+3价V具有还原性,易被氧气氧化。
回答下列问题:
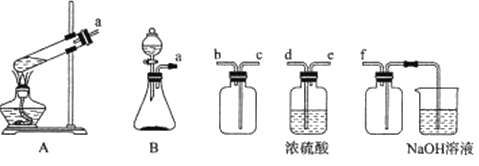
(1)实验室用Na2SO3固体和H2SO4(浓)制取SO2,可选用的发生装置是_____(填“A”或“B”),利用下述装置制取并收集干燥的SO2,连接顺序为a—____—____—____—_____—f。
(2)步骤I的装置如下;
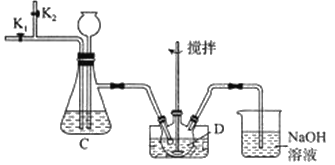
①盛放V2O5的仪器D的名称是_____,装置C中长颈漏斗的作用是_______。
②通入二氧化硫前和实验结束后都要通入N2,目的是________。
③写出步骤I中反应的离子方程式:___________。
(3)步骤II的洗涤操作中,证明已经洗净的方法是_________;实验中V2(CO3)3的产率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废物利用有利于环境保护、资源节约,一种从废催化剂(含ZnO、CuO及少量石墨、Fe2O3及MnO2等)回收铜并制取活性氧化锌的工艺流程如图:
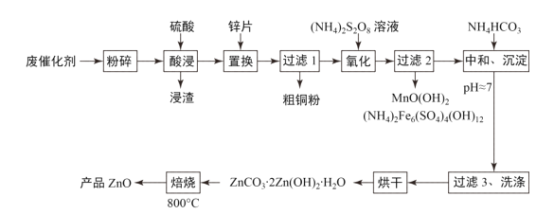
(1)为提高酸浸的速率,还可采取的措施为___。
(2)“氧化”时2molMn2+被氧化为MnO(OH)2,需要(NH4)2S2O8的物质的量为___。
(3)已知Zn(OH)2性质与Al(OH)3类似,在“中和、沉淀”时pH不能过大,请用文字结合离子方程式解释原因___。
(4)“过滤3、洗涤”时,对所得滤液蒸发浓缩、冷却结晶可得___(填主要物质的化学式)固体。
(5)“焙烧”过程中化学方程式为___。
(6)经测定,1kg废催化剂可得160g粗铜粉,又知粗铜粉中铜的质量分数为80%,则废催化剂中铜的质量分数为___%,若“酸浸”时硫酸浓度变小而又没有及时补充,则测定结果会比实际情况___(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.常温常压下,1.7gNH3含有NA个电子
B.标准状况下,22.4L水中含H2O分子NA个
C.1molNa完全反应生成NaCl时,失去NA个电子
D.常温常压下,22.4LCO2中含有的CO2分子数小于NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列叙述中正确的是( )
A. 常温下,1 L 0.1 mol·L-1 MgCl2溶液中含Mg2+数为0.1NA
B. 常温常压下的33.6 L Cl2与27g Al充分反应,转移电子数为3 NA
C. 1mol单质铁被氧化时一定失去3NA个电子
D. 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)是一种重要的化工产品。其制备工艺流程如下:
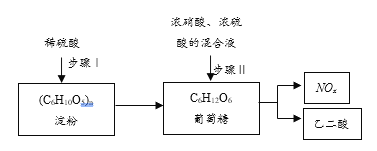
步骤Ⅱ中葡萄糖(结构简式: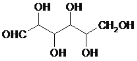 )被氧化成乙二酸,需控制反应温度为55~60℃,边搅拌边滴加浓硝酸、浓硫酸的混合液,可发生下列反应:
)被氧化成乙二酸,需控制反应温度为55~60℃,边搅拌边滴加浓硝酸、浓硫酸的混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
(1)步骤Ⅰ中淀粉水解成葡萄糖,使用______试剂可检验淀粉是否完全水解。
(2)步骤Ⅱ的氧化过程需控制反应温度为55~60℃的原因:①温度过低,则_______________;②温度过高,则_________________。
(3)检验氧化后的溶液中是否仍含有葡萄糖的实验方案是_______________。
(4)H2C2O4能使酸性KMnO4溶液褪色,配平离子方程式并标出电子转移的方向和数目。____H2C2O4+____MnO4-+____H+→____CO2↑+____Mn2++____H2O,______________
(5)若尾气NOx中,n(NO2):n(NO)=1:2,则每生产6.3kg乙二酸会产生标准状况下_____________L的NO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有200 mL MgCl2和AlCl3混合溶液,其中Mg2+浓度0.2mol/L、 Cl-浓度为1.3 mol/L。要使Mg2+转化成Mg(OH)2并使Mg2+、Al3+分离开来,至少需要4 mol/L NaOH溶液( )
A. 80mLB. 100mLC. 120mLD. 140mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com