考点:有关有机物分子式确定的计算,芳香烃、烃基和同系物
专题:烃及其衍生物的燃烧规律
分析:A.设烃的混合物的平均化学式为C
xH
y,在氧气中燃烧的化学方程式为:C
xH
y+(x+
)O
2xCO
2+
H
2O(l),根据体积变化,利用差量法计算判断;
B.A、B两种有机物组成混合物,当混合物的质量相等时,无论A、B以何种比例混合,完全燃烧产生CO
2的量均相等,则各组分中C元素质量分数相等;
C.等物质的量的有机物消耗相等的物质的量的氧气有以下几种情况:①分子间相差n个CO
2;②分子间相差n个H
2O;③分子间1个C相当于4个H,即少n个C要多4n个H;④互为同分异构体;
D.燃烧等质量的烃,烃中H元素质量分数越大,耗氧量越大.
解答:
解:A.设混合烃的平均组成为C
xH
y,则:
C
xH
y+(x+
)O
2xCO
2+
H
2O(l),△V
1 1+
50mL 100mL
则1+
=2 解得y=4
即混合气体分子中平均含有4个H原子即可,则三种烃可能是C
2H
4、C
2H
6、C
2H
2,故A正确;
B.A、B两种有机物组成混合物,当混合物的质量相等时,无论A、B以何种比例混合,完全燃烧产生CO
2的量均相等,则各组分中C元素质量分数相等,可能为同系物,若烯烃,故B正确;
C.当A与B的分子组成只相差n个“CO
2”时,消耗氧气的量相等,即A和B的相对分子质量的差值为44n,当A与B分子组成只相差n个“H
2O”时,消耗氧气的量相等,即A和B的相对分子质量的差值为18n,由于分子间1个C相当于4个H,即少n个C要多4n个H时,消耗氧气的量相等,A和B的相对分子质量的差值12n-4n=8n;当A与B互为同分异构体时,分子式相同,消耗氧气的量相等,则A和B的相对分子质量的差值为0,故C错误;
D.所有烃烃中,甲烷中H元素质量分数最大,燃烧等质量的烃,耗氧量最多的一定是甲烷,故D正确,
故选C.
点评:本题考查有机物燃烧有关计算,侧重考查学生分析解决问题的能力,难度中等.



 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案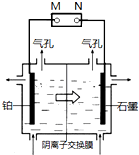 制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向.下列说法不正确的是( )
制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向.下列说法不正确的是( )