
| A. |  蒸馏水 | B. | 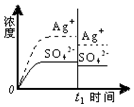 0.010mol•L-1 Ag2SO4溶液 | ||
| C. | 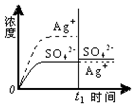 0.020mol•L-1 Na2SO4溶液 | D. | 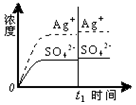 0.040mol•L-1 AgNO3溶液 |
分析 将适量Ag2SO4固体溶于100mL水中至刚好饱和,Ag2SO4刚好为100ml的饱和溶液,因为c(Ag+)=0.032mol•L-1,所以c(Ag2SO4)=0.0151mol•L-1;
A.加入100mL蒸馏水,溶液浓度减小;
B.已知c(Ag2SO4)=0.015mol•L-1;加入100mL 0.010mol•L-1 Ag2SO4,溶液浓度减小,银离子和硫酸根离子浓度都减小;
C.加入100mL 0.020mol•L-1 Na2SO4溶液,根据Qc与Ksp的相对大小分析溶液的变化;
D.加入100mL 0.040mol•L-1 AgNO3溶液,根据Qc与Ksp的相对大小分析溶液的变化.
解答 解:将适量Ag2SO4固体溶于100mL水中至刚好饱和,Ag2SO4刚好为100ml的饱和溶液,因为c(Ag+)=0.032mol•L-1,所以c(Ag2SO4)=0.0151mol•L-1;
A.加入100mL蒸馏水,溶液浓度减小,银离子浓度和硫酸根离子浓度都减小,大约为原来浓度的一半,故A正确;
B.已知c(Ag2SO4)=0.0151mol•L-1;加入100mL 0.010mol•L-1 Ag2SO4,溶液浓度减小,银离子浓度和硫酸根离子浓度都减小,故B正确;
C.加入100mL 0.020mol•L-1 Na2SO4溶液后,
c(Ag+)=$\frac{1}{2}$×0.032mol•L-1=0.0151mol•L-1,
c(SO42-)=(0.0151mol•L-1+0.02mol•L-1)×$\frac{1}{2}$=0.01755mol•L-1,
Qc=(0.0151mol•L-1)2×0.01755mol•L-1=4.0×10-6<Ksp=1.4×10-5,
所以没有沉淀析出,银离子浓度减小,硫酸根离子浓度增大,故C正确;
D.加入100mL 0.040mol•L-1 AgNO3溶液,c(Ag+)=$\frac{1}{2}$×(0.031mol•L-1+0.040mol•L-1)=0.0355mol•L-1,
c(SO42-)=$\frac{1}{2}$×0.0151mol•L-1=0.00755mol•L-1,
Qc=(0.0355mol•L-1)2×0.00755mol•L-1=9.5×10-6<Ksp=1.4×10-5,
所以没有沉淀析出,银离子浓度增大,硫酸根离子浓度减小,图中银离子浓度和硫酸根离子浓度都增大,故D错误;
故选:D.
点评 本题考查本题考查了溶度积常数的有关计算,题目难度中等,要求学生掌握溶度积常数的基本概念以及简单应用,通过比较溶度积与离子积的相对大小,可以判断难溶电解质在给定条件下沉淀能否生成或溶解,侧重于考查学生的分析能力和计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
 有关苏糖的说法不正确的是( )
有关苏糖的说法不正确的是( )| A. | 苏糖能发生银镜反应 | |
| B. | 苏糖属于单糖 | |
| C. | 苏糖在一定条件下,能发生加成和取代反应 | |
| D. | 苏糖与葡萄糖互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.| 时间(mol/L) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
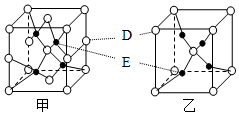 A、B、C、D、E五种元素的原子序数依次增大.A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态.试回答下列问题:
A、B、C、D、E五种元素的原子序数依次增大.A是原子半价最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
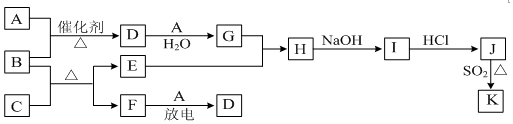
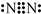
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率:前者快,后者慢 | |
| B. | 消耗硝酸的物质的量:前者多,后者少 | |
| C. | 反应生成相同条件下气体的体积:前者多,后者少 | |
| D. | 反应中转移的电子总数:前者多,后者少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═-+4NH4+ | |
| B. | 铅酸蓄电池充电时的正极反应:PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| C. | Fe2(SO4)3溶液与Ba(OH)2溶液反应:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ | |
| D. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:2NH4++Fe2++4OH-═Fe(OH)2↓+2NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO42- | B. | SO32- | C. | S | D. | S2- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com