
| A. | 2,3-二甲基-4-乙基戊烷 | B. | 2-甲基3,4-二乙基戊烷 | ||
| C. | 2,4-二甲基-3-乙基己烷 | D. | 2,5-二甲基-3-乙基己烷 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
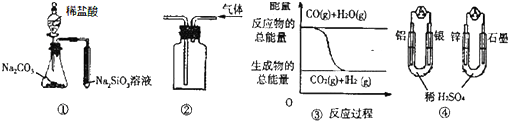
| A. | 用图 ①所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 用图 ②所示实验装置排空气法收集CO2气体 | |
| C. | 图 ③表示反应 CO(g)+H2O(g)?CO2(g)+H2(g)是放热反应 | |
| D. | 图 ④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若某钠盐溶液含甲电离出的阴离子,则该溶液既可能与酸反应又可能与碱反应 | |
| B. | 若乙与氧气的摩尔质量相同,则乙只能由2种元素组成 | |
| C. | 若丙中含有第2周期ⅣA族的元素,则丙可能是甲烷的同系物 | |
| D. | 若丁中各元素质量比跟甲中各元素质量比相同,则丁中一定含有-1价的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
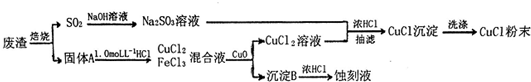
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-2-丁烯 | B. | 2,3-二甲基-1-丙烯 | ||
| C. | 3-甲基-1-丁烯 | D. | 2-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是中心原子采取sp3杂化轨道成键的分子,其空间立体结构都是正四面体 | |
| B. | 乙烯和苯分子每个碳原子都以sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 | |
| C. | 苯分子C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 | |
| D. | 凡是AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NCl3分子是非极性分子 | |
| B. | 分子中的所有原于均达到8电子稳定结构 | |
| C. | NBr3的熔点比NCl3的熔点低 | |
| D. | 分子中N-C1键键长比CCl4分子中C-C1键键长长 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com