

分析 (1)①反应自发进行的判断依据为△H-T△S<0;
②利用v=$\frac{△c}{△t}$计算v(CO),根据速率之比等于化学计量数之比求v(CO2);根据速率之比等于化学计量数之比求v(N2);根据随着反应进行反应速率越来越小分析;
③根据三行式结合化学平衡的移动知识来计算分析;
④压缩容器体积,增大了压强,正逆反应速率增大,平衡向着气体体减小的方向移动,据此画出从t2-t3-t4时段,正反应速率的变化曲线;
(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式,平衡常数=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,依据反应的平衡常数计算分析平衡常数的关系;
(3)脱硝率高,负载率低,适宜的温度;
(4)反应与NO2和NaOH反应相似,生成NaNO2、NaNO3和CO2,以此书写反应的化学方程式.
解答 解:(1)①反应 2NO(g)+2CO(g)?2CO2(g)+N2(g)能够自发进行,反应△S<0,若满足△H-T△S<0,必须△H<0,
故答案为:<;
②一氧化氮的反应速率为v(CO)=$\frac{△c}{△t}$=$\frac{(36-30.6)×1{0}^{-4}mol/L}{1s}$=5.4×10-3mol/L.s,同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,
同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以v(N2)=$\frac{1}{2}$v(CO)=2.7×10-4mol/(L.s);
因为随着反应进行反应速率越来越小,所以第2S消耗的CO小于第1S的36-30.6=5.4,则第2s时的30.6>x>30.6-5.4=25.2,
故答案为:2.7×10-4mol/(L.s);25.2<X<30.6;
③在一定温度下,向体积为 V L的密闭容器中充入一定量的NO和CO.在t1时刻达到平衡状态,此时n(CO)=a mol,n(NO)=2a mol,n(N2)=b mol.依据化学平衡三段式列式计算
2NO(g)+2CO(g)?N2(g)+2CO2(g)
起始量(mol) 2a+2b a+2b 0 0
变化量(mol) 2b 2b b 2b
平衡量(mol) 2a a b 2b
若保持体积不变,再向容器中充入n(CO2)=b mol,n(NO)=a mol,正逆进行程度相同,平衡不动,正逆反应速率相同;
故答案为:=;
④在t2时刻,将容器迅速压缩到原容积的$\frac{1}{2}$,在其它条件不变的情况下,瞬间氮气物质的量不变,浓度增大,相当于增大压强,平衡正向进行,氮气物质的量增大,最后不变,t3时刻达到新的平衡状态如图 ;
;
故答案为: ;
;
(2)①CH4(g)+2O2(g)═CO2(g)+2H2O(l) K1=$\frac{c(C{O}_{2}){c}^{2}({H}_{2}O)}{c(C{H}_{4}){c}^{2}({O}_{2})}$△H=a kJ•mol-1;
②N2(g)+O2(g)═2NO(g) K2=$\frac{{c}^{2}(NO)}{c({N}_{2})c({O}_{2})}$ △H=b kJ•mol-1;
依据盖斯定律计算,①-②×2得到CH4脱硝的热化学方程式为 CH4(g)+4NO(g)═CO2(g)+2N2(g)+2H2O(l)△H=(a-2b )kJ•mol-1;
K3=$\frac{c(C{O}_{2}){c}^{2}({N}_{2}){c}^{2}({H}_{2}O)}{c(C{H}_{4}){c}^{4}(NO)}$=$\frac{{K}_{1}}{{{K}_{2}}^{2}}$,
故答案为:(a-2b )kJ•mol-1;K3=$\frac{{K}_{1}}{{{K}_{2}}^{2}}$;
(3)满足脱硝率高,负载率低,适宜的温度,由图可知,适合条件为350℃、负载率3%.
故答案为:350℃、负载率3%;
(4)反应与NO2和NaOH反应相似,生成NaNO2、NaNO3和CO2,则反应的化学方程式为2NO2+Na2CO3=NaNO2+NaNO3+CO2,
故答案为:2NO2+Na2CO3=NaNO2+NaNO3+CO2.
点评 本题考查盖斯定律的应用、放热反应与吸热反应、热化学方程式的书写.难度中等.根据图象分析出分解率的变化特点是解题的关键,掌握基础是关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)(mol/L) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)(mol/L) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验 编号 | T(℃) | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0,△S>0 的反应任何条件都是非自发反应 | |
| B. | 放热反应均能自发进行,且反应放出的热量越多,反应越完全 | |
| C. | 某反应的△H>0、△S<0,则该反应一定不能正向进行 | |
| D. | 水从固态→液态→气态的变化过程中△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ( )
( )| A. | 根据图①可判断正反应的△H<0 | |
| B. | 图②可表示压强(p)对反应 2A(g)+2B(g)?3C(g)+D(s)的影响,P2 的压强大 | |
| C. | 图③可以表示的反应为 2A(g)+B(g)?C(g)△H<0 | |
| D. | 图④表示一定条件下,在绝热、恒容的密闭体系中进行的反应:NO(g)+NO2(g)?N2O3(g)△H<0,t1 时刻达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸 | |
| B. | 酸性氧化物都是非金属氧化物 | |
| C. | Na2O熔融状态下能导电,所以Na2O是电解质 | |
| D. | 胶体区别于其他分散系的本质特征是产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

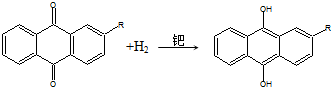
| A. | H2O2可用作漂白剂、消毒剂,也可作为火箭燃料 | |
| B. | H2O2可使湿润的KI淀粉试纸变蓝 | |
| C. | 蒽醌氧化法生产H2O2的实际结果是H2和O2生成H2O2 | |
| D. | H2O2化学性质稳定,便于储存和运输 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2Y的电离方程式:H2Y?2H++Y2- | |
| B. | HY- 离子水解的离子方程式:HY-+H2O?H2Y+OH- | |
| C. | 该酸式盐溶液中离子浓度大小关系:c(Na+)>c(HY-)>c(OH-)>c(H+) | |
| D. | 该酸式盐溶液中离子浓度关系:c(H+)+c(H2Y)═c(OH-)+c(Y2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com