
| A. | C2H6和C3H8 | B. | C5H10和C6H6 | C. | C2H6O和C2H4O2 | D. | C3H6和C3H8O2 |
分析 有机物无论它们以何种物质的量的比例混和,只要总物质的量一定,则在完全燃烧时,消耗氧气的量为一定值,若设有机物通式为CxHyOz,则根据(x+$\frac{y}{4}$-$\frac{z}{2}$)计算出的消耗氧气的量一定相等,据此进行解答.
解答 解:由CxHyOz+(x+$\frac{y}{4}$-$\frac{z}{2}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{2}$H2O可知,
有机物无论它们以何种物质的量的比例混和,只要总物质的量一定,则在完全燃烧时,消耗氧气的量为一定值,则(则根据(x+$\frac{y}{4}$-$\frac{z}{2}$)相等即符合题意,
A.2+$\frac{6}{4}$=3.5≠3+$\frac{8}{4}$=5,故A错误;
B.5+$\frac{10}{4}$=7.5=6+$\frac{6}{4}$,故B正确;
C.2+$\frac{6}{4}$-$\frac{1}{2}$=3≠2+$\frac{4}{4}$-$\frac{2}{2}$=2,故C错误;
D.3+$\frac{6}{4}$=4.5≠3+$\frac{8}{4}$-$\frac{2}{2}$=4,故D错误;
故选B.
点评 本题考查学生利用有机物燃烧的通式进行计算,明确信息消耗氧气的量为一定值得出(x+$\frac{y}{4}$-$\frac{z}{2}$)相等是解答本题的关键,不必利用化学反应方程式逐一计算,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ②④⑥⑦⑧⑨ | B. | ①②④⑥⑦⑧⑨ | C. | ①③④⑤⑥⑧⑩ | D. | ①②④⑧⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/kJ•mol-1 | I2/kJ•mol-1 | I3/kJ•mol-1 | I4/kJ•mol-1 | I5/kJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
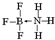 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
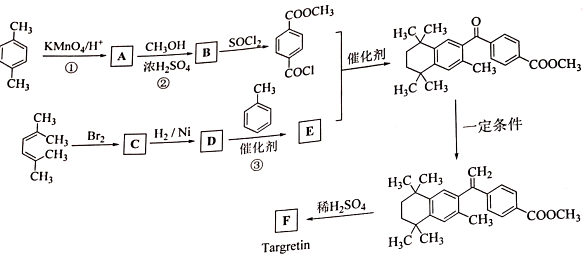
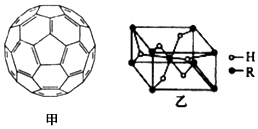
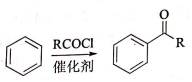 ②
②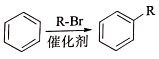
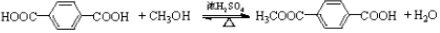 .
.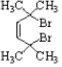 .
.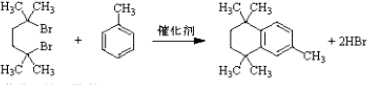 .
.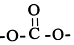 结构)
结构)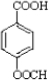 ,
,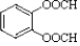 .
.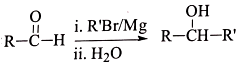 R-CH-R′(R、R′为烃基)
R-CH-R′(R、R′为烃基)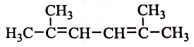 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
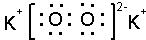 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实 验 Ⅰ | 操作 | 现象 |
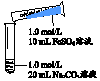 | 1、混合后出现白色絮状沉淀,振荡,部分沉淀呈灰绿色,无气泡产生 2、放置5-8分钟,灰绿色沉淀逐渐增多,最终变成红褐色 |
| 实验Ⅱ | 操作 | 现象 |
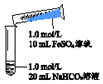 | 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、振荡,粘附在试管内壁的白色颗粒状浑浊变红棕色,且越来越多;20分钟后,白色浑浊明显沉降 |
| 实验Ⅱ | 操作 | 现象 |
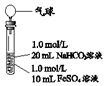 | 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、一段时间后将带有气球(排尽空气)的胶塞塞紧试管,振荡后放置5小时,气球膨胀,试管中沉淀物始终保持白色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素在人体内可以水解成葡萄糖 | |
| B. | 组成蛋白质的元素中,一定含有碳、氢、氧、氮 | |
| C. | 适量摄入油脂,有助于人体吸收多种脂溶性维生素 | |
| D. | 天然蛋白质水解后的最终产物是a-氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
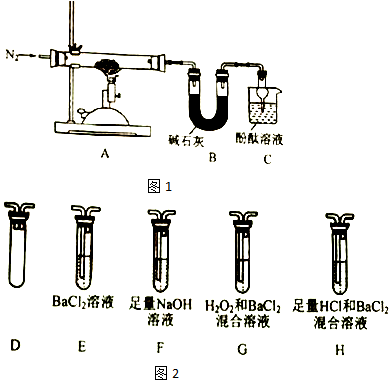
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com