
【题目】关于各图的说法(其中①③④中均为惰性电极)正确的是( )
A.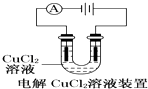
装置中阴极产生的气体能够使湿润淀粉KI试纸变蓝
B.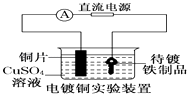
装置中待镀铁制品应与电源正极相连
C.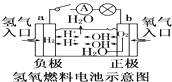
装置中电子由b极流向a极
D.
装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是
A. 阿伏加德罗常数的符号为NA,其近似值为6.02×1023 mol-1
B. 等物质的量的O2与O3,所含氧原子数相同
C. 在0.5 mol Na2SO4中,含有的Na+数约是6.02×1023
D. 摩尔是物质的量的单位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应:
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色.
探究1:白色沉淀产生的原因.
(1)白色沉淀是 .
(2)分析白色沉淀产生的原因,甲同学认为是NO3﹣氧化了SO2 , 乙同学认为是溶液中溶解的O2氧化了SO2 .
①支持甲同学观点的实验证据是 .
②依据甲的推断,请写出Ba(NO3)2溶液与SO2反应的离子方程式 .
(3)乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
实验操作 | 实验现象 |
向2mLmol/L溶液(填化学式)中通入SO2 |
(4)探究2:在氧化SO2的过程中,NO3﹣和O2哪种微粒起到了主要作用.
实验操作 | 实验数据 |
向烧杯中加入煮沸了的0.1mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 |
|
向烧杯中分别加入25mL 0.1mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2 , 用pH传感器分别测定溶液pH随时间(t)变化的曲线. |
|
图1,在无氧条件下,BaCl2溶液pH下降的原因是 .
(5)图2,BaCl2溶液中发生反应的离子方程式为 .
(6)依据上述图象你得出的结论是 , 说明理由 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下列氧化还原反应中化合价变化的关系,氧化剂和氧化产物都正确的是
化学反应方程式 | 氧化剂 | 氧化产物 | |
A | 3Cl2+2Fe | Fe | FeCl3 |
B | 2 Na+2 H2O===2 NaOH+H2↑ | H2O | NaOH |
C | 2HClO | HClO | HClO |
D | Cl2+Na2SO3+H2O =2HCl+Na2SO4 | Cl2 | HCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作与实验现象不匹配的是( )
反应 | 现象 | |
A | 把明矾溶液滴入含悬浮泥沙的水中 | 产生不溶物 |
B | 在氯气中点燃氢气 | 产生苍白色火焰 |
C | 将氯气通入紫色石蕊溶液 | 溶液最终由紫色变为红色 |
D | 向硅酸钠浓溶液中滴入稀硫酸 | 出现胶状物 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L的K2SO4溶液、0.2mol/L的Al2(SO4)3溶液和纯水混合,要使混合液中的K+、Al3+、SO42﹣的浓度分别为0.1mol/L、0.1mol/L、0.2mol/L,则所取的K2SO4溶液、Al2(SO4)3溶液、纯水三者体积比( )
A.1:1:1
B.2:1:2
C.1:1:2
D.2:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于1mol CO2(相对分子质量:44)的叙述正确的是
A. 质量为44g/molB. 摩尔质量为44g
C. 标准状况下的体积约为22.4LD. 分子数为1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不能用元素周期律解释的是
A.浓硝酸的氧化性强于稀硝酸B.与冷水反应的速率:Na>Mg
C.向淀粉KI溶液中滴入溴水,溶液变蓝D.原子半径:Al>Si>P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应N2(g)+3H2(g)2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内H2的反应速率为( )
A.1.2mol/(Lmin)
B.1.8 mol/(Lmin)
C.0.6mol/(Lmin)
D.2.4mol/(Lmin)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com