
| A. | 生铁比软铁芯(几乎是纯铁)容易生锈 | |
| B. | 银质奖牌久置后表面变暗 | |
| C. | 铁质器件附有铜质配件,在接触处易生铁锈 | |
| D. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 |
分析 根据是否能构成原电池判断,如果金属能构成原电池的就能产生电化学腐蚀,否则不能产生电化学腐蚀,据此分析解答.
解答 解:A.生铁中金属铁、碳、潮湿的空气能构成原电池,金属铁为负极,易被腐蚀而生锈,和电化学腐蚀有关,故A不选;
B.银质奖牌长期放置后在其奖牌的表面变暗是由于金属银和空气中的成分发生反应的结果,属于化学腐蚀,与电化学腐蚀无关,故B选;
C.铁质器件附有铜质配件,在接触处形成原电池装置,其中金属铁为负极,易生铁锈,和电化学腐蚀有关,故C不选;
D.黄铜(铜锌合金)制作的铜锣中,金属锌为负极,金属铜做正极,Cu被保护,不易腐蚀,和电化学腐蚀有关,故D不选;
故选B.
点评 本题考查金属的腐蚀,注意在原电池中,负极金属易被腐蚀,正极金属被保护,明确化学腐蚀和电化学腐蚀的区别即可解答,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
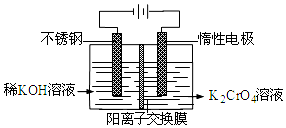
| A. | 在阴极式,发生的电极反应为:2H2O+2e-═2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;电解\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 铬原子的价电子排布式为3d44S2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取53.0g Na2CO3固体 | |
| B. | 需要的玻璃仪器有500mL容量瓶、烧杯、玻璃棒、胶头滴管、量筒 | |
| C. | 转移溶液时有少量液体溅出,则最终溶液的浓度偏高 | |
| D. | 定容时仰视刻度线,则最终溶液的浓度偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两次平衡时,C(g)的浓度相等 | |
| B. | 平衡时,单位时间内n(B)生成:n(C)消耗=1:1 | |
| C. | 若再向平衡体系中加入少量A,平衡不移动 | |
| D. | 若开始时向容器中加入1 mol B和1 mol C,则达到平衡时吸收QkJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
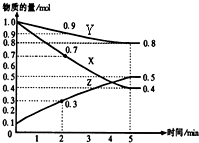 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示:
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L乙烯含有的共用电子对数为5NA | |
| B. | lmolNaHSO4中的阳离子数为2NA | |
| C. | 通常状况下,lmolNO和0.5molO2在密闭容器中混合,生成NO2分子数为NA | |
| D. | 制取漂白粉时,标准状况下22.4LC12参加反应,转移电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com