
第三周期五种元素A、B、C、D、E,A和B的最高价氧化物对应的水化物呈碱性,且碱性B>A;C和D的气态氢化物的水溶液呈酸性,且酸性C>D;五种元素所形成的简单离子中,E的离子半径最小,则它们的原子序数由大到小的顺序是( )
A. CDEAB B. ECDAB C. BAEDC D. BADCE
科目:高中化学 来源: 题型:
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2 xH2O)。有如下操作:
xH2O)。有如下操作:

已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。检验溶液A中Fe2+的最佳试剂为_____(填编号,下同)。
①KMnO4 ②(NH4)2S ③NaOH ④ KSCN
(2)氧化剂可选用_________。①Cl2 ②KMnO4 ③HNO3 ④H2O2
(3)要得到较纯的产品,试剂可选用_______________。①NaOH ②FeO ③CuO ④Cu2(OH)2CO3
(4)从滤液经过结晶得到氯化铜晶体的方法是_____________(按实验先后顺序选填编号)。
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(5)欲测定溶液A中的Fe2+的浓度,实验前,首先要配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、药匙、胶头滴管外,还需_________,下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。
(6)为了测定制得的氯化铜晶体(CuCl2 xH2O)中的x值,某学生设计了两种实验方案:
xH2O)中的x值,某学生设计了两种实验方案:
方案一:称取mg晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n1g
方案二:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止,冷却,称量所得固体的质量为n2g。
试评价上述两种实验方案:其中正确的方案是________,理由是___________,据此计算得x=_________(用含m、n1或n2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在乙烯分子(C2H4)中既有σ键又有π键,它们分别是:
A.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
B.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
C.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
查看答案和解析>>
科目:高中化学 来源: 题型:
关于离子键、共价键的各种叙述中,下列说法中正确的是( )
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.在共价化合物分子内,一定不存在离子键
D. 任何物质里都含有化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
同一主族的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性强弱是
H3XO4<H3YO4<H3ZO4,下列推断正确的是( )
A.原子序数:X<Y<Z B.气态氢化物稳定性:XH3<YH3<ZH3
C.元素的非金属性强弱:X>Y>Z D.电子层数:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为( )
A.A>B>C>D B.C>A>B>D C.A>C>D>B D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药。某学校的化学兴趣小组的同学对绿矾进行了如下的探究:
(一) FeSO4•7H2O的制备
该化学兴趣小组的同学在实验室通过如下实验由废铁屑(含少量氧化铜、氧化铁等杂质)制备FeSO4·7H2O晶体:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去
Na2CO3溶液,然后将废铁屑用水洗涤2~3遍。
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50~80℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2~3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。
请回答下列问题:
(1)实验步骤①的目的是 。
(2)实验步骤②明显不合理,理由是 。
(3)为了洗涤除去晶体表面附着的硫酸等杂质,实验步骤④中用少量冰水洗涤晶体,原因是 。
(二)探究绿矾(FeSO4·7H2O)热分解的产物
 已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
已知SO3的熔点是16.8°C,沸点是44.8°C,该小组设计如下图所示的实验装置(图中加热、夹持仪器等均省略):
【实验过程】
①仪器连接后,检查装置A与B气密性;
②取一定量绿矾固体置于A中,通入N2以驱尽装置内的空气,关闭k,用酒精灯加热硬质玻璃管;
③观察到A 中固体逐渐变红棕色,B中试管收集到无色液体,C中溶液褪色;
④待A中反应完全并冷却至室温后,取少量反应后固体于试管中,加入硫酸溶解,取少量滴入几滴KSCN溶液,溶液变红色;
⑤往B装置的试管中滴入几滴BaCl2溶液,溶液变浑浊。
(4)实验结果分析
结论1:B中收集到的液体是 ;
结论2:C中溶液褪色,可推知产物中有 ;
结论3:综合分析上述实验③和④可推知固体产物一定有Fe2O3。
【实验反思】
(5)请指出该小组设计的实验装置的明显不足: 。
(6)分解后的固体中可能含有少量FeO,取上述实验④中盐酸溶解后的溶液少许于试管中,选用一种试剂鉴别,该试剂最合适的是 。
a. 氯水和KSCN溶液 b. 酸性KMnO4溶液 c. H2O2 d. NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
随着对有机高性能纤维的不断深入研究,美国已开发出一种超高性能纤维,该纤维不仅具有PBO纤维的抗张性能,而且还有优于PBO纤维的抗压缩性能。下面是以对二甲苯为原料合成该纤维的合成路线(有些反应未注条件)。请回答:
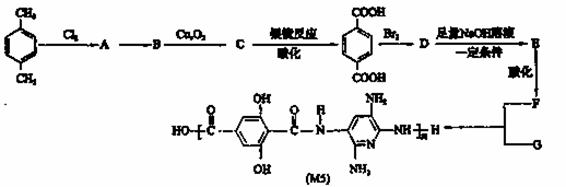
(1)写出合成该纤维的单体F的结构简式: 。
(2)反应类型:A→B ,B→C 。
(3)写出化学方程式(注明反应条件):
B→C ; D→E 。
(4)若1molF与足量Na2CO3溶液完全反应,则消耗Na2CO3 mol
(5)写出两种符合下列条件物质的结构简式: 、 。
①与B互为同分异构体②遇FeCl3溶液有显色反应
③核磁共振氢谱有3组峰,且峰面积之比为3:1:1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com