
 如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )
如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将不会出现的现象是( )| A. | 气球a被吹大 | B. | 试管b内有气泡冒出 | ||
| C. | U形管内红色褪去 | D. | U形管水位d高于c |
分析 Na2O2与水反应生成氢氧化钠和氧气,反应为2Na2O2+2H2O═4NaOH+O2↑,反应放热,可使广口瓶内压强增大,过氧化钠具有强氧化性,以此解答该题.
解答 解:A.反应生成氧气,则气球a变大,故A正确;
B.反应生成气体,则试管b中有气泡冒出,故B正确;
C.由于浅红色的水是在U形管中而非试管中,则试管内溶液不变色,U形管内的红水不褪色,故C错误;
D.产生O2使气球膨胀,该反应放出大量热量,使锥形瓶中空气受热膨胀而出现U形管中水位d>c,故D正确;
故选C.
点评 本题考查实验装置的综合应用,为高频考点,把握过氧化钠的性质、装置的作用等为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2与H2SO4两稀溶液混合:Ba2++OH-+H++S042-═BaS04↓+H2O | |
| B. | AlCl3溶液中加入过量氨水:Al3++3NH3.HO═Al(OH)3↓+3NH4+ | |
| C. | 将Na投入到CuS04溶液:2Na+Cu2+═2Na++Cu | |
| D. | 等物质的量的MgCl2、NaOH和HCl溶液混合:Mg2++20H一═Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往紫色石蕊试液中通入氨气,溶液变蓝 | |
| B. | 饱和FeCl3溶液在沸水中变成红褐色胶体 | |
| C. | 向FeSO4溶液中滴加NaOH溶液,生成的沉淀由白色变成灰绿色,最后变成红褐色 | |
| D. | SO2使滴有酚酞的NaOH溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.
合成氨工业的核心反应是N2(g)+3H2(g)?2NH3(g);反应过程中能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

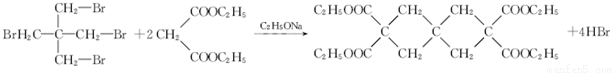
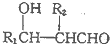 (R1、R2为烃基或H)
(R1、R2为烃基或H)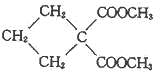 +HBr+HCl
+HBr+HCl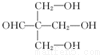 .
. .
.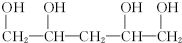 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 普通锌锰干电池碳棒是负极,锌片是正极 | |
| B. | 盛水的铁器,在空气与水交界处更容易锈蚀 | |
| C. | 为防止金属的腐蚀可在金属表面涂油漆、油脂 | |
| D. | 用盐酸与锌反应制取氢气,含有杂质的锌比纯锌产生氢气速度快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:①CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H20,CH2=CH2+Br2→BrCH2-CH2Br
已知:①CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H20,CH2=CH2+Br2→BrCH2-CH2Br| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 通常状况下的状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 熔点/℃ | -130 | 9 | -116 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知25℃时部分弱电解质的电离平衡常数数据如下表:
已知25℃时部分弱电解质的电离平衡常数数据如下表:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com