
| A. | 纯碱和烧碱都属于碱 | |
| B. | 凡是能电离出H+的化合物都叫做酸 | |
| C. | 铝片在空气中能剧烈燃烧并放出大量的热 | |
| D. | NH3的水溶液可以导电,但NH3属于非电解质 |
分析 A、纯碱为碳酸钠,烧碱为NaOH;
B、电离出的阳离子全部是氢离子的化合物为酸;
C、铝在空气中能缓慢氧化,不能剧烈燃烧;
D、氨气溶于水后生成的一水合氨能导电.
解答 解:A、纯碱为碳酸钠,烧碱为NaOH,而电离出的阴离子全部是氢氧根的化合物为碱,故烧碱为碱,而纯碱为盐,故A错误;
B、电离出的阳离子全部是氢离子的化合物为酸,能电离出氢离子的不一定是酸,如naHSO4,故B错误;
C、铝在空气中能缓慢氧化,不能剧烈燃烧,之有在氧气中能剧烈燃烧,故C错误;
D、氨气溶于水后生成的一水合氨能导电,和氨气没有关系,故氨气是非电解质,故D正确.
故选D.
点评 本题考查了酸、碱、盐以及电解质非电解质的判断,难度不大,掌握概念的要点是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应容器内的压强不随时间改变 | |
| B. | 反应容器内P、Q、R、S四者共存 | |
| C. | P的生成速率和S的生成速率相等 | |
| D. | 反应容器内的气体总物质的量不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体系的压强不再改变 | |
| B. | 体系的温度不再改变 | |
| C. | 消耗1molN2的同时,新生成3molH2 | |
| D. | 反应消耗的N2、H2与产生的NH3的速率υ(N2):υ(H2):υ(NH3)═1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNa2O2与足量H2O充分反应转移的电子数为2NA | |
| B. | 200mL,1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子总数为6.02×1023 | |
| C. | 已知2A(g)+B(g)═2C(g)△H=-akJ/mol,若将2NA个A与NA个B混合充分反应放出akJ的热量 | |
| D. | 28gSi3N4晶体中含有的硅氮键的数目为2.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
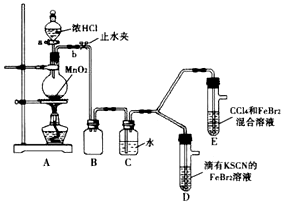
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适置浓盐酸,然后关闭活塞a,点燃酒精灯 | D装罝中:溶液变红,E装置中:水层溶液变黄,振荡后CCl4层无明显变化 | Cl2、Br2、Fe2+的氧化性由强到弱的顺序为Cl2>Br2>Fe3+ |
| i.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2 ii.Cl2和Br2反应生成BrCl,它呈红色(略带黄色)沸点约为5℃,与水发生水解反应 iii.AgClO、AgBrO均可溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
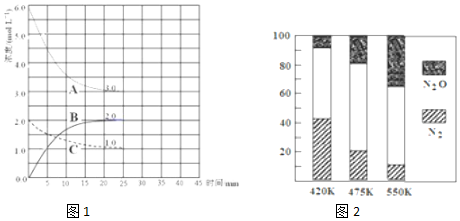
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
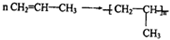
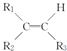 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$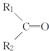 +R3-COOH,
+R3-COOH,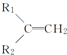 $\stackrel{KMnO_{4}(H+)}{→}$
$\stackrel{KMnO_{4}(H+)}{→}$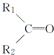 +CO2
+CO2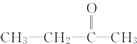 ),则此烯烃的结构简式是CH2=C(CH3)C2H5.
),则此烯烃的结构简式是CH2=C(CH3)C2H5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol 任何气体的体积都约是22.4L | |
| B. | lmolH2和O2的混合气体,在标准状况下的体积也是22.4L | |
| C. | lmol H2气态物质,当体积为22.4L 时,该气体一定处于标准状 | |
| D. | 2mol 气体体积约为44.8L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与Al反应产生氢气的溶液:K+、Na+、SO42-、HCO3- | |
| B. | 溶液中c(H+)/c(OH-)=1014:Fe2+、Na+、SO42-、NO3- | |
| C. | PH=12的溶液:Na+、K+、AlO2-、Cl- | |
| D. | 溶液中水所电离的H+和OH-满足c(H+)•c(OH-)=10-26:NH4+、Mg2+、SO42-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com