
| A. | 125 mL | B. | 275 mL | C. | 325 mL | D. | 450 mL |
分析 20mL 1mol/L的AlCl3溶液中氯化铝的物质的量=0.02L×1mol/L=0.02mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.02mol×78g/mol=1.56g>1.17g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,结合方程式计算消耗氢氧化钠物质的量,进而计算需要氢氧化钠溶液体积.
解答 解:20mL 1mol/L的AlCl3溶液中氯化铝的物质的量=0.02L×1mol/L=0.02mol,若Al元素都转化为氢氧化铝沉淀,则氢氧化铝沉淀的质量=0.02mol×78g/mol=1.56g>1.17g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2.
n(Al(OH)3)=$\frac{1.17g}{78g/mol}$=0.015mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.015mol×3=0.045mol,
加入NaOH溶液的体积为$\frac{0.045mol}{0.2mol/L}$=0.225L=225mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,则:
Al3++3OH-═Al(OH)3↓
0.02mol 0.06mol 0.02mol
溶解的氢氧化铝为0.02mol-0.015mol=0.005mol
Al(OH)3 +OH-═AlO2-+2H2O
0.005mol 0.005mol
则消耗的碱的物质的量为0.06mol+0.005mol=0.065mol,
加入NaOH溶液的体积为$\frac{0.065mol}{0.2mol/L}$=0.325L=325mL;
故选C.
点评 本题考查方程式的有关计算,题目难度中等,关键是根据氯化铝与氢氧化铝的量判断发生的反应,再结合反应的有关方程式计算.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③⑥ | B. | ②⑤ | C. | ③⑤⑥ | D. | ④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中肼作还原剂 | |
| B. | 液态肼的燃烧热△H为-641.6kJ•mol-1 | |
| C. | 该动力源的突出优点之一是生成物对环境污染小 | |
| D. | 肼和过氧化氢反应的热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片接电源的正极 | |
| B. | 铜片上发生的反应是:Ag++e-═Ag | |
| C. | 银片上发生的反应是:4OH--4e-═O2↑+2H2O | |
| D. | 需用硫酸铜溶液为电镀液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
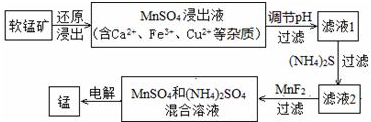
| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀HNO3中滴加Na2SO3溶液SO32-+2H+═SO2↑+H2O | |
| B. | CuSO4溶液与H2S反应的离子方程式:Cu2++S2-═CuS↓ | |
| C. | 氯气溶于水:Cl2+H2═2H++Cl-+ClO- | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2═4Na++2Cu(OH)2↓+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com