
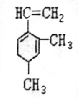
 己知某有机物的结构简式如图,它是具有环状结构的不饱和烃.
己知某有机物的结构简式如图,它是具有环状结构的不饱和烃.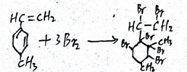 ;
;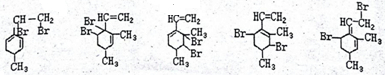 .
. 科目:高中化学 来源: 题型:选择题
| A. | NO2-酸性氧化物 Na2O2-碱性氧化物 Al2O3-两性氧化物 | |
| B. | 盐酸-混合物 胆矾-纯净物 金刚石-单质 | |
| C. | 纯碱-碱 硫化氢-酸 小苏打-酸式盐 | |
| D. | 液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 能源是当今社会发展的三大支柱之一,有专家指出:如果对燃料产物如CO2、H2O、N2等能够实现利用太阳能让它们重新组合(如图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化( )
能源是当今社会发展的三大支柱之一,有专家指出:如果对燃料产物如CO2、H2O、N2等能够实现利用太阳能让它们重新组合(如图),可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化( )| A. | 化学能 | B. | 热能 | C. | 生物能 | D. | 电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
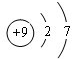 ,C2-的电子式
,C2-的电子式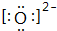 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com