
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
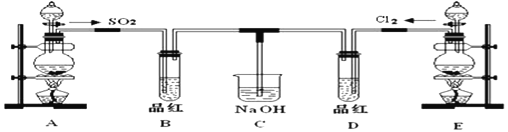
(1)实验室用装置E制备Cl2,离子方程式为__________________。
(2)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是: B:______________,D:_________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:____________,D:_________________。
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)________________。
【答案】 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 褪色 褪色 恢复为红色 不恢复 Cl2+SO2+2H2O=2HCl+H2SO4
Mn2++Cl2↑+2H2O 褪色 褪色 恢复为红色 不恢复 Cl2+SO2+2H2O=2HCl+H2SO4
【解析】(1)实验室用MnO2和浓盐酸在加热的条件下制备氯气,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)①氯气和二氧化硫都能是品红溶液褪色,所以B和D装置中品红都褪色,故答案为:品红褪色;品红褪色;
②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,所以看到的现象是B中溶液由无色变为红色,D中无明显现象,故答案为:由无色变为红色或恢复为红色;无明显现象或不恢复;
(3)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性,化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl;故答案为:SO2+Cl2+2H2O=H2SO4+2HCl。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】在1.013×105Pa下,测得的某些烷烃的沸点见下表。据表分析,下列选项正确的是( )
物质名称 | 沸点/℃ |
正丁烷CH3(CH2)2CH3 | -0.5 |
正戊烷CH3(CH2)3CH3 | 36.1 |
异戊烷 | 27.8 |
新戊烷 | 9.5 |
正己烷CH3(CH2)4CH3 | 69.0 |
A. 在标准状况时,新戊烷是气体 B. 在1.013×105 Pa、20℃时,C5H12都是液体
C. 烷烃随碳原子数增加,沸点降低 D. C5H12随支链增加,沸点降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶滚中加入金属铝有氢气放出,则在此溶液中一定能大量共存的离子是
A. K+、Na+、Cl-、HCO3- B.K+、NH4+、Cl-、CO32-
C. K+、Fe2+、NO3-、SO42- D. K+、Na+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢分子中含有过氧键(﹣O﹣O﹣).有机化合物A的相对分子质量为120.经分析,其中氧的质量分数为0.5334,其余为碳和氢,则A分子中过氧键数最多为( )
A.1
B.2
C.3
D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
有机物H是药物常山酮的合成中间体,合成H的流程图如下:
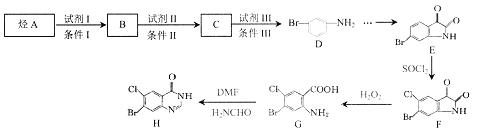
已知:① 苯环上原有取代基对新导入苯环上的取代基位置有一定影响,其规律如下:
-OH、-CH3、-Br等取代基使新导入的取代基主要进入原取代基邻位和对位;
-NO2、-SO3H、-CHO等取代基使新导入的取代基主要进入原取代基间位。
②![]() (-NH2易被氧化)
(-NH2易被氧化)
③ 甲苯可被酸性高锰酸钾氧化为苯甲酸
回答下列问题:
(1)D中的官能团名称为_________。
(2)E→F的反应类型为__________。
(3)B→C的化学反应方程式为___________。
(4)G在一定条件下能发生缩聚反应,该反应方程式为__________。
(5)W与B是同系物,W与B的最大质荷比相差14,同时满足下列条件的W的同分异构体有_______种。
① 能与NaOH溶液反应 ② 苯环上有两个取代基 ③ 遇氯化铁溶液不显色
其中核磁共振氢谱显示为4组峰,且峰面积比为1:2:2:2的所有物质的结构简式是______。
(6)写出以甲苯为原料合成![]() 的流程图(无机试剂任用)_______
的流程图(无机试剂任用)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。

(1)乙醇分子中官能团的名称是_______。
乙酸中的官能团的结构简式 ________。
(2)试管a中加入几块碎瓷片的目的是____________。
(3)试管a中发生反应的化学方程式为_______________________,反应类型是__________。
(4)反应开始前,试管b中盛放的溶液是____________。
(5)可用____________的方法把制得的乙酸乙酯分离出来。
(6)浓硫酸的作用 _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,在某含有Fe3+和Cu2+的溶液中,c(Fe3+)为4.0×10-8mol·L-1现向该溶液中滴加氨水,当开始出现氢氧化铁沉淀时,溶液的pH及溶液中允许的最大c(Cu2+)为
A. 10 2.2 mol·L-1 B. 4 2.2×10-1 mol·L-1
C. 4 2.2 mol·L-1 D. 10 2.2×10-1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、写出下列有机物的结构简式(或根据结构简式写出名称):
(1)2,6-二甲基-4-乙基辛烷:________________________________;
(2)2,5-二甲基-2,4己二烯:________________________________;
(3)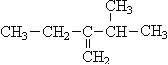 ________________________________。
________________________________。
Ⅱ、(1)一气态烷烃和一气态烯烃组成混合气体共10g,混合气体的密度是相同条件下氢气的12.5倍,该混合气体通过溴水时,溴水增重8. 4 g ,混合气体的组成为_____________,
混合气体中烷烃和烯烃的体积比为_________。
(2)乙烯与丙烷混合气体共amol,与bmol氧气共存于一密闭容器中,点燃后充分反应,乙烯和丙烷全部消耗完,得到CO和CO2的混合气体和54g水。试求a的取值范围__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com