

分析 ①依据反应物状态和反应条件选择仪器,A适合固体+固体加热制备气体,B适合液体+固体(液体不加热)制备气体;二氧化碳能够使澄清石灰水变浑浊;
②浓盐酸易挥发,氯化氢能够与硝酸银反应生成氯化银沉淀;制出纯净干燥的氢气,应除去氢气中的氯化氢和水蒸气,固体氢氧化钠能够吸收氯化氢和水.
解答 解:①实验室制备氧气用高锰酸钾固体加热制备气体,选择A装置,或者用二氧化锰固体做催化剂,过氧化氢分解生成氧气,选择装置B;制氢气用锌与稀硫酸不加热,选择B装置;
二氧化碳能够使澄清石灰水变浑浊,检验二氧化碳气体可选用盛有澄清石灰水的D装置;
故答案为:A或者B;B;B 澄清石灰水;
②浓盐酸易挥发,氯化氢能够与硝酸银反应生成氯化银沉淀,离子方程式为:Cl-+Ag+═AgCl↓;固体氢氧化钠能够吸收氯化氢和水,可以除去氢气中的氯化氢和水蒸气,制出纯净干燥的氢气;
故答案为:HCl;Cl-+Ag+═AgCl↓;C;吸水和HCl气体.
点评 本题考查了常见气体的制备及除杂,熟悉装置特点,依据反应物状态和反应条件选择合适的发生装置是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氢键是一种较弱的化学键 | |
| B. | NH3的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 常温下,Cl2、Br2、I2的状态从气态、液态到固态,主要原因是分子间作用力在逐渐增大 | |
| D. | 最外层能达到稳定结构的微粒只是稀有气体的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
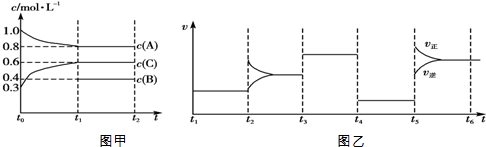
| A. | 该反应为吸热反应 | |
| B. | B在t0~t1阶段平衡时转化率为60% | |
| C. | t4~t5阶段改变的条件为减小压强 | |
| D. | 此温度下该反应的化学平衡常数K=$\frac{27}{32}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+2OH-=2H2O+2e- | B. | O2+4H++4e-=2H2O | ||
| C. | H2-2e-=2H+ | D. | O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正戊烷<异戊烷<新戊烷 | B. | 正戊烷>新戊烷>异戊烷 | ||
| C. | 邻二甲苯>间二甲苯>对二甲苯 | D. | 邻二甲苯<间二甲苯<对二甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY3可能是共价化合物 | |
| B. | 若Y的原子序数为m,则X的原子序数只能是m±4 | |
| C. | X和Y可在同一周期,也可在两个不同的周期? | |
| D. | X和Y可在同一周期,也可在同一主族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com