

分析 NaCl、FeCl3、Al2(SO4)3组成的粉末加入水中溶解后,加入氯化钡溶液沉淀硫酸根离子得到沉淀B为BaSO4,溶液A为氯化钠、氯化铁、氯化铝溶液,加入试剂X为过量氢氧化钠溶液,生成沉淀D为氢氧化铁,加热分解生成氧化铁质量为1.60g,溶液C为偏铝酸钠和氯化钠溶液,加入稀硫酸,沉淀F为氢氧化铝,溶液E为硫酸钠,
(1)流程分析判断,固体与液体分离的实验操作是过滤;
(2)沉淀D为氢氧化铁,反应的离子方程式为:Fe3++3OH-=Fe(OH)3;
(3)溶液A为氯化钠、氯化铁、氯化铝溶液,加入试剂X为过量氢氧化钠溶液,C中含有的阴离子为Cl-、OH-、AlO2-等;
(4)E中含有氯化钠、硫酸钠等溶质,如加入硝酸银可生成硫酸银沉淀,不能检验是否含有氯离子;
(5)J、Y均为金属单质,反应VI为铝热反应;
(6)依据硫酸根离子守恒和铁元素守恒计算硫酸铝和氯化铁的质量得到原物质中氯化钠的质量.
解答 解:NaCl、FeCl3、Al2(SO4)3组成的粉末加入水中溶解后,加入氯化钡溶液沉淀硫酸根离子得到沉淀B为BaSO4,溶液A为氯化钠、氯化铁、氯化铝溶液,加入试剂X为过量氢氧化钠溶液,生成沉淀D为氢氧化铁,加热分解生成氧化铁质量为1.60g,溶液C为偏铝酸钠和氯化钠溶液,加入稀硫酸,沉淀F为氢氧化铝,溶液E为硫酸钠,
(1)流程分析判断,固体与液体分离的实验操作是过滤,Ⅱ、Ⅲ、Ⅳ为过滤操作,故答案为:Ⅱ、Ⅲ、Ⅳ;
(2)沉淀D为氢氧化铁,反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓;
故答案为:Fe3++3OH-=Fe(OH)3↓;
(3)溶液A为氯化钠、氯化铁、氯化铝溶液,加入试剂X为过量氢氧化钠溶液,C中含有的阴离子为Cl-、OH-、AlO2-等,故答案为:Cl-、OH-、AlO2-;
(4)E中含有氯化钠、硫酸钠等溶质,如加入硝酸银可生成硫酸银沉淀,不能检验是否含有氯离子,故答案为:不行;
(5)J、Y均为金属单质,反应VI为铝热反应,反应的化学方程式为Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,故答案为:Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(6)依据硫酸根离子守恒和铁元素守恒计算硫酸铝和氯化铁的质量得到原物质中氯化钠的质量;
加入氯化钡溶液沉淀硫酸根离子得到沉淀B为BaSO4,n(Al2(SO4)3)=$\frac{1}{3}$n(BaSO4)=$\frac{1}{3}$×$\frac{6.99g}{233g/mol}$=0.01mol,
n(FeCl3)=2n(Fe2O3)=2×$\frac{1.60g}{160g/mol}$=0.02mol,
元混合物中氯化钠质量=13.69g-0.01mol×342g/mol+0.02mol×162.5g/mol=7.02g,
物质的量=$\frac{7.02g}{58.5g/mol}$=0.12mol,
故答案为:0.12mol.
点评 本题考查综合考查物质的推断以及物质的分离、提纯,为高频考点,侧重于学生的分析、计算能力的考查,把握流程中各步发生的反应及操作为解答的关键,题目难度不大.


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
 把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图.经过一段时间后,首先观察到溶液变红的区域是( )
把锌片和铁片放在盛有含酚酞的稀食盐水的玻璃器皿中,如图.经过一段时间后,首先观察到溶液变红的区域是( )| A. | Ⅰ和Ⅲ附近 | B. | Ⅰ和Ⅳ附近 | C. | Ⅱ和Ⅲ附近 | D. | Ⅱ和Ⅳ附近 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 十五种 | B. | 十六种 | C. | 十七种 | D. | 十八种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以收集到氯气$\frac{22.4b}{2{N}_{A}}$L | B. | 反应后Cl-数目为bc-d | ||
| C. | NA可表示为$\frac{87d}{2a}$ | D. | 反应后溶液中的H+数目为bc-2d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
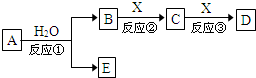 由短周期元素组成的中学常见物质A、B、C、D、E存在图转化关系(部分生成物和反应条件略).
由短周期元素组成的中学常见物质A、B、C、D、E存在图转化关系(部分生成物和反应条件略).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇可由淀粉、纤维素等在一定条件下制得 | |
| B. | 乙醇、乙酸生成乙酸乙酯的反应属于取代反应 | |
| C. | 乙醇可与NaOH稀溶液反应 | |
| D. | 乙醇与二甲醚(CH3 OCH3)是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com