
| A. | C2H4与C4H8一定是同系物 | |
| B. | 丙烯和乙烷都能使高锰酸钾酸性溶液褪色 | |
| C. | 1丁烯与2丁烯互为同分异构体 | |
| D. | 新戊烷和2,2二甲基丙烷互为同分异构体 |
分析 A.某有机物分子式为C4H8,可能是单烯烃或环丁烷;
B.乙烷属于烷烃,不能使酸性高锰酸钾褪色;
C.同分异构体分子式相同,结构不同的化合物;
D.同分异构体分子式相同,结构不同的化合物;
解答 解:A.C2H4为乙烯,C4H8可能是单烯烃或环丁烷,如果是烯烃,则与乙烯是同系物,如果是环丁烷,则与乙烯不是同系物,故A错误;
B.丙烯能使高锰酸钾酸性溶液褪色,而乙烷不能使高锰酸钾酸性溶液褪色,故B错误;
C.1-丁烯与2-丁烯分子式相同,结构不同,故互为同分异构体,故C正确;
D.新戊烷和2,2-二甲基丙烷分子式相同,结构也相同,故为同一种物质,故D错误;
故选C.
点评 本题考查同系物、同分异构体的概念及判断,难度不大.要注意基础知识的积累.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:填空题
 碳元素能够形成不同的单质,如C60、C70、金刚石等等.
碳元素能够形成不同的单质,如C60、C70、金刚石等等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | t1时减小了A(g)的浓度,增加了C(g)的浓度,平衡向逆反应方向移动 | |
| B. | t1时升高了温度,平衡向逆反应方向移动 | |
| C. | t1时增加了A(g)和B(g)的浓度,平衡向正反应方向移动 | |
| D. | t1时减小了压强,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL、1mol•L-1的AlCl3溶液中,含Al3+的数目为0.1NA | |
| B. | 46g乙醇中所含共价键的数目为8NA | |
| C. | 1mol氧气与足量金属钠反应,氧气一定得到4NA个电子 | |
| D. | 100mL、18.4mol/L的硫酸与足量铜反应,生成二氧化硫的分子数0.92NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的原子结构决定了元素在周期表中的位置 | |
| B. | 同一周期从左到右,元素的金属性逐渐增强、非金属性逐渐减弱 | |
| C. | 第IA元素全部是金属元素 | |
| D. | 可在过渡元素中寻找半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| W | X | Y | |
| Z |
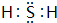 .
.
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2ZO3+4HI═Z↓+2I2+3H2O |
| ① | 还原性 | |
| ② | H2ZO3+2NaOH═Na2ZO3+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以2-氯丙烷为主要原料制备1,2-丙二醇[CH3CH(OH)CH2OH]时,依次经过的反应类型为消去反应-加成反应-取代反应 | |
| B. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| C. | 有机物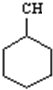 的一氯代物有4种 的一氯代物有4种 | |
| D. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O |
查看答案和解析>>
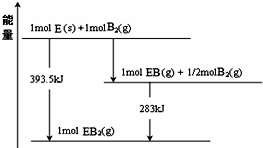
科目:高中化学 来源: 题型:选择题
| A. | X的能量一定高于N | |
| B. | 断开X、Y中的化学键吸收的能量大于形成M、N中化学键放出的能量 | |
| C. | X、Y的总能量一定高于M、N的总能量 | |
| D. | 因该反应是放热反应,故不加热一定可以反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com