
【题目】氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。工业ZnO中含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ),纯化工业ZnO的流程如下:
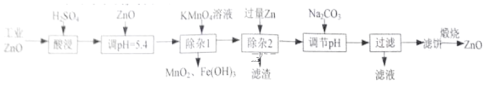
提示:在本实验条件下,Ni(Ⅱ)不能被氧化。
(1)“酸浸”时需不断通入髙温水蒸气,其目的是 ________________。
(2)“除杂I”中生成Fe(OH)3反应的离子方程式为______________________________。
(3)“除杂2”中所得滤渣主要成分是____________。
(4)滤饼要用水洗,检验是否洗涤干净的方法是_________________。
(5)已知:Zn(OH)2 的 Ksp=l×10-17。室温下为使Zn2+完全沉淀(其浓度<1×10-5mol·L-1),需调节溶液pH范围为____________。
【答案】升高温度、使反应物充分混合,以加快反应速率 3Fe2++MnO4-+7H2O=3Fe(OH)3↓+MnO2↓+5H+ Ni、Zn 取少量最后洗涤液于试管中,滴入盐酸酸化的氯化钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净 pH>8
【解析】
(1) “酸浸”时需不断通入髙温水蒸气是为了升高温度、使反应物充分混合,以加快反应速率,据此解答;
(2) 根据题意,Ni(Ⅱ)不能被氧化,反应②中除掉的杂质离子是Fe2+和Mn2+,根据MnO4-+具有氧化性,能将Fe2+和Mn2+氧化,根据电子得失进行配平;
(3) “除杂2”中所得滤渣为锌与镍离子的发生反应得到锌离子和镍;得到的滤渣中,除了过量的锌外还有金属镍;
(4)检验沉淀是否洗涤干净的方法是取最后一次洗涤液,检验表面是否含有硫酸根离子;
(5)根据Zn(OH)2 的 ![]() 和室温下
和室温下![]() 计算。
计算。
工业ZnO中放入稀硫酸酸浸后溶液中存在Fe2+、Mn2+、Zn2+和Ni2+,向浸出液中加入适量ZnO并调节溶液的pH约为5.4,再加入高锰酸钾溶液,Ni(Ⅱ)不能被氧化,Fe2+、Mn2+被氧化生成氢氧化铁和二氧化锰而被除去,过滤后,向滤液中加入Zn过滤,Zn和Ni2+发生氧化还原反应生成Ni,溶液中存在Zn2+,向滤液中加入碳酸钠溶液并调节pH,生成碳酸锌沉淀,煅烧碳酸锌沉淀生成ZnO,
(1) “酸浸”时需不断通入髙温水蒸气是为了升高温度、使反应物充分混合,以加快反应速率,故答案为:升高温度、使反应物充分混合,以加快反应速率;
(2)根据上述分析可知,“除杂I”中Fe2+被氧化生成Fe(OH)3,反应的离子方程式为:3Fe2++MnO4-+7H2O=3Fe(OH)3↓+MnO2↓+5H+,故答案为:3Fe2++MnO4-+7H2O=3Fe(OH)3↓+MnO2↓+5H+;
(3) 根据上述分析可知,“除杂2”中加入Zn过滤,Zn和Ni2+发生氧化还原反应生成Ni,还有过量的Zn,因此滤渣为Ni和Zn,故答案为:Ni、Zn;
(4) 由于溶液中硫酸根离子属于杂质离子,因此可以检验测定洗涤液中是否存在硫酸根离子,操作为:取最后一次少量水洗液于试管中,滴入12滴稀盐酸,再滴入氯化钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净,故答案为:取少量最后洗涤液于试管中,滴入盐酸酸化的氯化钡溶液,若无白色沉淀生成,则说明沉淀已经洗涤干净;
(5) 已知:Zn(OH)2 的 ![]() ,室温下为使Zn2+完全沉淀(其浓度<1×10-5mol·L-1),因此可知当Zn2+其浓度为1×10-5mol·L-1时,根据
,室温下为使Zn2+完全沉淀(其浓度<1×10-5mol·L-1),因此可知当Zn2+其浓度为1×10-5mol·L-1时,根据![]() 计算得c(OH-)=10-6mol/L, 室温下水的离子积常数
计算得c(OH-)=10-6mol/L, 室温下水的离子积常数![]() ,把c(OH-)=10-6mol/L带入得c(H+)=10-8mol/L,因此需调节溶液pH范围为pH>8,故答案为:pH>8。
,把c(OH-)=10-6mol/L带入得c(H+)=10-8mol/L,因此需调节溶液pH范围为pH>8,故答案为:pH>8。


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】下列关于盐类水解的应用中,说法正确的是( )
A. 加热蒸干Na2CO3溶液,最后可以得到NaOH和Na2CO3的混合固体
B. 除去MgCl2中的Fe3+,可以加入NaOH固体
C. 明矾净水的反应:Al3++3H2O![]() Al(OH)3+3H+
Al(OH)3+3H+
D. 加热蒸干KCl溶液,最后得到KOH固体(不考虑与CO2的反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1;
CH3OH(g)+H2O(g) △H1;
②CO(g)+2H2(g)![]() CH3OH(g) △H2
CH3OH(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3;
CO(g)+H2O(g) △H3;
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | X |
回答下列问题:
(1)已知△H2=-99 kJ·mol-1,则根据上表相关的化学键键能(“C![]() O”表示CO的化学键)计算X=_______ kJ·mol-1。
O”表示CO的化学键)计算X=_______ kJ·mol-1。
(2)反应①、②、③对应的平衡常数K1、K2、K3之间的关系式为___________。
(3)根据化学反应原理,分析增大压强对反应③的影响为_______________。(提示:从对反应速率、平衡状态、转化率角度回答)
Ⅱ.清洁能源具有广阔的开发和应用前景,可减小污染解决雾霾问题,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池。一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)△H=-99kJmol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)△H=-99kJmol-1。向体积为2L的密闭容器中充入2molCO和4molH2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
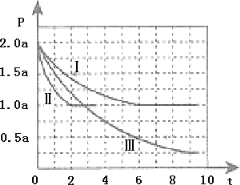
①Ⅱ和Ⅰ相比,改变的反应条件是_________;
②反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=_____;
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=_________;
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中含有的Cr2O72-和CrO42-会对水体产生很大的危害,因此这种工业废水必须净化处理。一种处理含铬废水的工艺流程如下:
CrO42—![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3↓
Cr(OH)3↓
①中反应为2 CrO42-(黄色)+2H+Cr2O72-(橙色)+H2O。
下列说法正确的是
A.①中,酸化后废水黄色变浅
B.②中,反应的氧化剂与还原剂的物质的量之比为3︰1
C.③中,所得沉淀Cr(OH)3中含有Fe(OH)3
D.①中,所加酸可以是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。
已知:① CO(g)+![]() O2(g) = CO2 (g) △H=-283kJ·mol-1
O2(g) = CO2 (g) △H=-283kJ·mol-1
② H2(g)+![]() O2(g) = H2O (g) △H=-241.8kJ·mol-1
O2(g) = H2O (g) △H=-241.8kJ·mol-1
③ H2O (l)=H2O (g) △H=+44.0kJ·mol-1
(1)H2的燃烧热△H=________。
(2)写出CO(g)和H2O (g)作用生成CO2 (g)和H2(g)的热化学方程式:________。
(3)相关物质的化学键键能数据如下:
化学键 | O=O(O2) | H—H | H—O |
E/(kJ·mol-1) | x | 436 | 463 |
计算x=________kJ·mol-1。
(4)某反应2X(g)+Y(g)2Z(g) △H= -Q kJ·mol-1,反应过程中能量变化如图所示,其中虚线表示加入催化剂M时的情况。
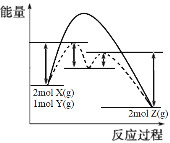
①加入催化剂M后,△H________ (填“改变”或“不变”)。
②在使用催化剂的两部反应中,________ (填“第一步”或“第二步”)决定反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同的容器中,在不同的条件下进行合成氨反应,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是
A.v (N2)=0.2molL﹣1min﹣1B.v (N2)=5molL﹣1s﹣1
C.v (NH3)=0.1molL﹣1min﹣1D.v (H2)=0.3molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象、结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向 | 上层液体呈橙红色 | 氧化性: |
B | 向 | 白色沉淀不溶解 |
|
C | 向盛有 | 溶液变蓝绿色,试管底有红色沉淀 | 氧化性: |
D | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化的铝滴落 | 生成 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列两套实验装置,用于实验室制取乙酸乙酯和乙酸丁酯。下列说法错误的是
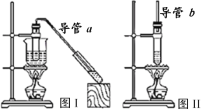
A.导管a和导管b的作用都是冷凝回流
B.都可用饱和Na2CO3溶液来洗去酯中的酸和醇
C.加入过量的乙酸可以提高醇的转化率
D.图I装置用于制取乙酸乙酯,图Ⅱ装置用于制取乙酸丁酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )
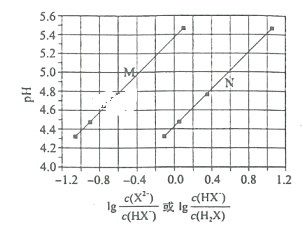
A.Ka1(H2X)的数量级为10-5
B.曲线N表示pH与lg![]() 的变化关系
的变化关系
C.NaHX溶液显碱性
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com